|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Обработка и оформление результатов ⇐ ПредыдущаяСтр 2 из 2
Результаты измерений заносят в таблицу, обращая внимание на диапазон измерений и размерность величины. Значения молярной электропроводности λ (См·см2·моль-1) вычисляют по формуле
где λ (См·см2·моль-1), χ (См·см-1), С (моль/л).
Таблица. Результаты измерений и данные для построения графика зависимости молярной электропроводности раствора сильного электролита NaCl от концентрации.
Строят график в координатах l от l¥ эксп= Абсолютная ошибка опыта(Δλ∞) и относительная (w%) ошибка определения l¥ . Значение l¥теор вычисляют по табличным данным как сумму l¥ катиона и аниона: l¥ теор= l¥ Na++ l¥ Cl- = …
Тема: ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОГО ЭЛЕКТРОЛИТА НА ОСНОВАНИИ ЗАВИСИМОСТИ ЭЛЕКТРОПРОВОДНОСТИ ОТ КОНЦЕНТРАЦИИ. Литература:Лекция №6; [1]: С. 283-300. Цель: приобретение навыков измерения электропроводности раствора при помощи цифрового кондуктометра, определение константы диссоциации слабого электролита на основании зависимости электропроводности от концентрации кондуктометрическим методом. Реактивы и оборудование: Кондуктометр цифровой с электродом, раствор CH3COOH 0,5 моль/л; вода дистиллированная, бюретка объемом 50 мл, воронка, стакан объемом 50 мл (под бюретку), пронумерованные мерные колбы объемом 100 мл с пробкой — 4 штуки, высокий стакан объемом 150 мл для измерений электропроводности. Теоретические основы Методы экспериментального определения Кд основаны на особых способах графического отображения результатов измерения электропроводности. В растворах слабых электролитов концентрация ионов невелика, расстояния между ними значительны, поэтому можно считать, что электростатические взаимодействия отсутствуют, ионы способны передвигаться с большой скоростью. Степень диссоциации слабого электролита отражает долю молекул, распавшихся на ионы и равна отношению молярной электропроводности раствора к электроповодности при бесконечном разбавлении
что объясняет нелинейность зависимости слабого электролита от С1/2 (в отличие от сильных электролитов). Логарифмирование приводит к уравнению прямой в координатах lgl — lgC:
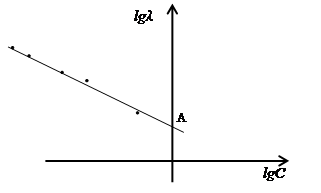
Линейная зависимость lgl от lgС наблюдается экспериментально при условии, что Кд вычисляют из найденной графически величины А (рис.9)
Рис. 9. Определение Кд слабого электролита по уравнению
Поиск по сайту: |
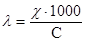 ,
, (на миллиметровой бумаге или как результат компьютерного построения), из графика определяют l¥эксп
(на миллиметровой бумаге или как результат компьютерного построения), из графика определяют l¥эксп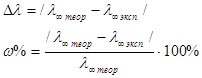
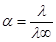 . Согласно закону разбавления Оствальда Кд = Сa2/(1−a). Для разбавленных растворов
. Согласно закону разбавления Оствальда Кд = Сa2/(1−a). Для разбавленных растворов 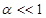 и Кд =Сa2. Тогда
и Кд =Сa2. Тогда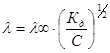
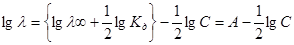
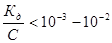 .
. .
.