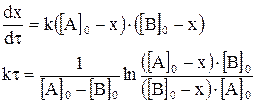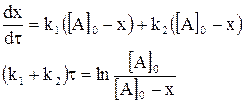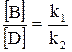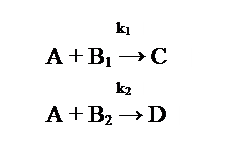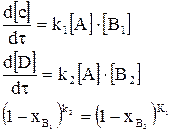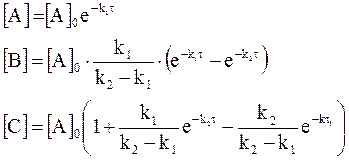|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
В стандартных условияхСтр 1 из 3Следующая ⇒
Кинетика химического равновесия
Химическая кинетика изучает скорости химических реакций. Скорость химической реакции в газовой фазе или в растворе определяется изменением числа молей N вещества в единицу времени в единице объема:
Знак плюс используется, когда скорость определяется по продукту, минус – по исходному веществу. Если реакция протекает при постоянном объеме, скорость выражают через молярную концентрацию Скорость реакции выражается в различных единицах: В последнем случае скорость выражается через парциальные давления газообразных веществ. Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализаторов. Зависимость скорости от концентрации описывается основным постулатом химической кинетики – законом действующих масс: Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени. Для реакции: А + В → С + D
к – константа скорости, не зависящая от концентрации; m и n – порядок реакции по веществам А и В. Сумма m + n называется общим порядком реакции. Константа скорости реакции численно равна скорости реакции при концентрациях реагирующих веществ, равных 1 Константа скорости реакции зависит от температуры ( уравнение Аррениуса):
R – газовая постоянная; Е – энергия активизации. Приближенно зависимость константы скорости реакции от температуры выражается уравнением Ванг – Гоффа:
Уравнение Аррениуса позволяет рассчитать энергию активизации реакции по константам скорости при двух температурах:
Рассмотрим кинетические уравнения для реакций разных порядков. Для реакции нулевого порядка
Глубина реакции Для реакции первого порядка
Для реакции второго порядка
Это уравнение используется, если реагирует одно вещество А по реакции второго порядка или два вещества А и В одинаковыми концентрациями. Если
Параллельные реакции первого порядка:
Кинетическое уравнение записывается с учетом принципа независимости: если в системе протекает несколько простых реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций:
Для параллельных реакций первого порядка в любой момент времени отношение продуктов реакции постоянно и определяется отношением констант скоростей реакций:
Параллельные реакции второго порядка:
Кинетические уравнения скоростей образования конечных продуктов равны:
Глубина превращения реагентов определяется соотношением констант скоростей. Для последовательной реакции первого порядка
кинетические уравнения для изменения концентраций веществ А, В и С записывается следующим образом:
с начальными условиями
Решение их дает:
Концентрация промежуточного продукта В достигаем максимального значения при
Поиск по сайту: |
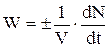
 , которая имеет размерность моль
, которая имеет размерность моль 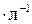 .
.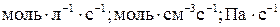 .
. , где
, где
 , где
, где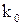 – предэкспоненциальный множитель;
– предэкспоненциальный множитель; , где
, где и
и 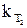 – константы скорости реакции при температурах Т1 и Т2;
– константы скорости реакции при температурах Т1 и Т2; - температурный коэффициент скорости.
- температурный коэффициент скорости.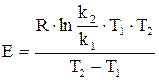




 , кинетическое уравнение имеет вид:
, кинетическое уравнение имеет вид: