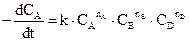|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Основні поняття та визначення хімічної кінетики
Швидкістю хімічної реакції W - називають змінювання кількості будь-якої речовини (або вихідної, або продукту) ni за одиницю часу t та за одиниці реакційного простору R:
Цей вираз використовують зі знаком “плюс” , коли швидкість реакції визначають за змінюванням кількості продукту реакції (яка є позитивною), або зі знаком “мінус”, коли швидкість реакції визначають за змінюванням кількості будь-якої вихідної речовини (яка є негативною). У обох випадках швидкість реакції залишається позитивною. Наведене визначення швидкості хімічної реакції є загальним, воно справедливе для будь-яких реакцій. Якщо реакція гомогенна та проходить у об’ємі, то реакційним простором є об’єм (R º V). Якщо реакція гетерогенна і проходить на поверхні розподілу фаз, то реакційним простором є ця поверхня (R º S). Найбільш теоретично описаними з точки зору хімічної кінетики є гомогенні реакції в ізольованих або закритих системах. Тому розглянемо на прикладі таких систем основні закономірності хімічної кінетики. Це можуть бути або газові реакції, або реакції між розчинами (за умови, що реагуюча суміш є однією фазою). У цьому випадку для швидкості реакції можна записати:
Якщо V = const, то враховуючи, що ni/V = Ci, де Сі – концентрація будь-якого компонента, можна записати
Вирішимо ще одне принципове питання. Нехай у системі проходить гомогенна реакція за участю речовин А, В, D, F: аА + вВ та концентрації речовин відповідно дорівнюють СА, СВ, СD i CF. Тоді для однозначного визначення швидкості реакції достатньо стежити за змінюванням концентрації однієї будь-якої речовини. Змінювання концентрацій усіх інших учасників реакції можна знайти із співвідношення
Математичне рівняння, що пов’язує швидкість реакції з концентраціями речовин, що реагують, називають кінетичним рівнянням даної хімічної реакції. Слід зазначити, що за зовнішнім виглядом рівняння хімічної реакції не можна зробити висновок про її кінетичне рівняння (у хімічній термодинаміці за зовнішнім виглядом рівняння можна провести розрахунок різних величин, наприклад, константи рівноваги). Реакції водню з парами йоду або брому виражаються однаковими стехіометричними рівняннями. Однак кінетичні рівняння для них різні, а саме: Н2 + І2= 2НІ,
H2+ Br2 = 2HBr
Це пояснюється тим, що перша реакція проходить як елементарна, у той самий час утворення HBr проходить у результаті складної ланцюгової реакції, механізм якої можна подати так: Br2 Br + H2 H + Br2 Таким чином, кінетичне рівняння хімічної реакції може бути встановлене виключно експериментальним шляхом. Основним законом хімічної кінетики, що випливає з великої кількості експериментальних даних і виражає залежність швидкості від концентрації являється закон діючих мас, який формулюється так: Швидкість реакції у кожний момент часу пропорційна добутку концентрацій реагуючих речовин, піднесених до деяких ступенів. Якщо емпіричне рівняння реакції аА + bB + dD то математичну формулу основного закону можна подати у вигляді:
У цьому рівнянні коефіцієнт пропорційності k не залежить від концентрацій. Він дуже різний для різних реакцій і значно залежить від температури. Називають k константою швидкості реакції. Фізичний вміст k легко знайти, ураховуючи, що СА = СВ = СD = 1 моль/л. Тоді W = =k, тобто k чисельно дорівнює швидкості реакції за концентраціями реагуючих речовин, що дорівнюють одиниці. Показники ступенів nA, nB, nD, як правило, є позитивними цілими числами, але іноді бувають дробові і навіть негативні показники. Поява цих ускладнень пояснюється більш або менш складним механізмом реакції.
Поиск по сайту: |
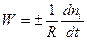
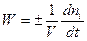
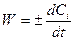
 dD + fF
dD + fF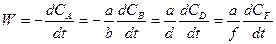
 Уведемо поняття про елементарну реакцію. Такою реакцією називається реакція, що проходить у відповідності до її рівняння, тобто за рахунок одночасного зіткнення молекул, що записані у лівій частині рівняння. Слід сказати, що з цих позицій у елементарній реакції можуть брати участь одна, дві або, що спостерігається дуже рідко, три молекули. Тому елементарні реакції підрозділяються на моно-, бі- та тримолекулярні.
Уведемо поняття про елементарну реакцію. Такою реакцією називається реакція, що проходить у відповідності до її рівняння, тобто за рахунок одночасного зіткнення молекул, що записані у лівій частині рівняння. Слід сказати, що з цих позицій у елементарній реакції можуть брати участь одна, дві або, що спостерігається дуже рідко, три молекули. Тому елементарні реакції підрозділяються на моно-, бі- та тримолекулярні.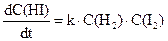
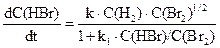
 2Br,
2Br,