 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Влияние различных факторов на скорость химических реакцийСтр 1 из 2Следующая ⇒
Лабораторная работа № 4 Тема «Химическая кинетика и катализ». Вопросы теории.
Теоретическая часть Химическая кинетика изучает скорость и молекулярный механизм химических реакций. Одним из основных понятий в химической кинетике является скорость химической реакции. Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ в единицу времени. Концентрацию обычно выражают числом молей в одном литре раствора, а время – в секундах. Таким образом, выражение для определения средней скорости химической реакции имеет вид:
где С0 – начальная концентрация вещества, моль/л; Cτ – конечная концентрация вещества, моль/л; τ – время реакции, сек; υ – средняя скорость химической реакции в этом промежутке времени, моль/л.с. Истинная скорость реакции в данный момент времени определяется как первая производная от концентрации С по времени t. Если С – концентрация исходного вещества, то в соответствии с тем, что dt > 0, а dC < 0, получим величину мгновенной скорости реакции:
Таким образом, если концентрация С убывает со временем (dC < 0, dτ >0), то значение производной Влияние различных факторов на скорость химических реакций Скорость реакции зависит от природы реагирующих веществ и от условий протекания реакции: концентрации реагентов, температуры и присутствия катализаторов. Для реакций с участием твердых веществ, скорость реакции зависит также от степени их измельчения (дисперсности), а для газов – от давления, т.к. в этом случае с изменением давления меняется концентрация реагентов. 1. Зависимость скорости реакции от природы реагирующих веществ: 2. Зависимость скорости реакции от концентрации для элементарных процессов выражается законом действующих масс, который был открыт в 1867 году норвежскими учеными К.Гульдбергом и П.Вааге. Скорость химической реакции при постоянной температуре прямопропорциональна произведению концентрации реагирующих веществ, взятых в степенях равных стехиометрическим коэффициентам в химическом уравнении реакции. aA + bB →← cC + dD
V1= k1 [A]a [B]b, V2= k2[C]c [D]d.
где [A],[B], [C] и [D] – равновесные молярные концентрации веществ; k – константа скорости химической реакции, численно равная скорости реакции, когда произведение концентраций реагирующих веществ равно единице. Константа скорости зависит только от природы реагирующих веществ, температуры и присутствия катализаторов, но не зависит от концентраций реагирующих веществ. В реакциях с участием твердых веществ (гетерогенные системы) скорость зависит от поверхности соприкосновения между реагирующими веществами и не зависит от массы твердого вещества: С(тв.) + О2 (г.) = СО2 (г.) υ = k[O2] , Характер зависимости скорости реакции от концентрации реагирующих веществ определяется ее порядком, равным сумме показателей степеней в уравнении закона действующих масс. Часто имеет место несовпадение порядка реакции с суммой коэффициентов. Это обусловлено тем, что рассматриваемая реакция протекает в несколько стадий. Пример:
Порядок этой реакции равен единице и выражение скорости реакции записывается как
Общая скорость таких реакций определяется скоростью более медленной стадии. В этом примере – скоростью первой стадии. Молекулярность реакции – число молекул, принимающих участие в элементарном акте химического взаимодействия. Различают моно-, би-, три-, и т.д. молекулярные реакции. Чаще всего встречаются бимолекулярные реакции. 3. Зависимость скорости реакции от температуры. Энергия активации. В большинстве случаев нагревание резко повышает скорость химической реакции. Например, осуществить синтез воды из водорода и кислорода при небольшой температуре и без катализаторов практически невозможно. Но при температуре 6000С скорость химической реакции возрастает настолько, что реакция идет со взрывом. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа (1884г). При повышении температуры на каждые 10?С, скорость химической реакции возрастает примерно в 2-4 раза. Правило Вант-Гоффа выражается следующим уравнением:
где
Химическое взаимодействие молекул происходит лишь в том случае, если молекулы приближаются на расстояние, при котором происходит перераспределение электронной плотности и возникновение новых химических связей. Т.е. сталкивающиеся молекулы должны обладать энергией, необходимой для преодоления сил отталкивания (энергии барьера) между их электронными оболочками. Частицы, обладающие такой энергией, называют активными. Избыточная (по сравнению со средней) энергия, которой должна обладать молекула для того, чтобы она могла вступить в химическое взаимодействие, называется энергией активации (Еа). Группировку активных частиц, находящихся в процессе взаимодействия (т.е. перераспределения связей), называют активированным комплексом. Пример:
Реакция протекает через образование промежуточного активного комплекса H2I2.
Образование переходного активного комплекса энергетически более выгодно, чем протекание реакции через полный разрыв связей молекул исходных веществ. Для большинства реакций величина энергии активации находится в пределах 15-60 ккал/моль. Образование активированного комплекса характеризуется непрерывным изменением расстояний между взаимодействующими атомами. В этом заключается его существенное отличие от обычной молекулы, в которой средние расстояния между атомами не зависят от времени. Активированный комплекс соответствует такому состоянию системы, при котором потенциальная энергия достигает максимального значения. Последовательность промежуточных состояний, через которые проходит система в ходе элементарного акта, называется путем, или координатой реакции.
Рис. 1. Реакционный путь процесса H2(г) + I2(г) = 2HI(г) Зависимость скорости реакции от температуры и энергии активации строго определяется уравнением Аррениуса для вычисления константы скорости химической реакции:
где А – предэкспоненциальный множитель, или фактор частоты, связанный с вероятностью и числом столкновений молекул; е – основание натурального логарифма; Е – энергия активации; R – универсальная газовая постоянная; Т – абсолютная температура. Общее число соударений молекул в единицу времени обозначается параметром Z. А=Z, если молекулы сферические (идеальный случай). Обычно Z >A. Это расхождение тем больше, чем сложнее структура реагирующих молекул. И объясняется тем, что кроме превышения энергии активации для химических взаимодействий важна определенная взаимная ориентация молекул. Вероятность надлежащей ориентации молекул при соударении характеризуется энтропией активации ΔSa. Она пропорциональна отношению числа благоприятных способов ориентации к общему числу способов ориентации. В результате зависимость скорости реакции от температуры, энергии активации и энтропии активации определяется следующим выражением:
где е – основание натурального логарифма; Е – энергия активации; R – универсальная газовая постоянная; Т – абсолютная температура; ΔS – энтропия активации; Z - число соударений молекул в единицу времени.
4. Влияние катализатора на скорость реакции Катализаторы – вещества, изменяющие скорость химической реакции, но сами остающиеся в конце реакции химически неизменными. Изменение скорости химической реакции под действием катализатора называется катализом. Катализаторы, увеличивающие скорость химической реакции, называются положительными, а катализаторы, уменьшающие скорость реакции – отрицательными, или ингибиторами. Существует два вида катализа: гомогенный и гетерогенный. Гомогенный катализ – процесс, при котором катализатор и реагирующие вещества находятся в одной фазе. Гетерогенный катализ – процесс, при котором катализатор и реагирующие вещества находятся в разных фазах. Сущность механизма действия катализатора при гомогенном катализе заключается в образовании промежуточного реакционноспособного соединения.
Механизм гетерогенного катализа иной, и объясняется теорией активированной адсорбции. Адсорбция – свойство вещества поглощать на своей поверхности другие вещества. На поверхности катализатора адсорбируются реагирующие вещества (за счет того, что поверхность катализатора неоднородна и на ней имеются так называемые активные центры). Процесс протекает в несколько стадий, и промежуточными являются поверхностные соединения. Это приводит к снижению энергии активации. В общем случае катализатор ведет реакцию по другому пути, чем тот, по которому реакция протекает без катализатора. Катализатор всегда измельчают и наносят на инертный носитель с развитой поверхностью. Например, синтез аммиака на железном катализаторе:
Поиск по сайту: |
 (9.1),
(9.1), (9.2)
(9.2) отрицательно. Для того чтобы мгновенная скорость реакции была всегда положительной, перед значением производной необходимо поставить знак минус, т.е.
отрицательно. Для того чтобы мгновенная скорость реакции была всегда положительной, перед значением производной необходимо поставить знак минус, т.е.  .
.


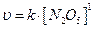 , а не
, а не  , т.к. реакция идет по стадиям:
, т.к. реакция идет по стадиям:
 (9.5),
(9.5), - первоначальная скорость химической реакции при температуре t1;
- первоначальная скорость химической реакции при температуре t1; - скорость химической реакции при температуре t2;
- скорость химической реакции при температуре t2; - температурный коэффициент скорости химической реакции, находящийся в пределах от 2 до 4.
- температурный коэффициент скорости химической реакции, находящийся в пределах от 2 до 4.

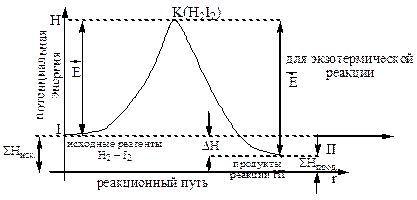
 (9.6),
(9.6), (9.7),
(9.7),
