 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Задачи для домашнего задания. 1-8. Противоионы диффузного слоя в золе, полученном по приведенной реакции (табл ⇐ ПредыдущаяСтр 5 из 5
1-8. Противоионы диффузного слоя в золе, полученном по Таблица 2.2
9–15. Для получения золя смешали растворы А и Б (табл. 2.3). Какое вещество надо взять в избытке, чтобы получить золь с положительно заряженными частицами? Составьте схему мицеллы.
Таблица 2.3
16. Какой объем раствора AgNO3 с СЭК = 0,018 моль экв/л надо прибавить к 0,025 л раствора НCl с СЭК = 0,16 моль экв/л, чтобы получить отрицательно заряженные частицы золя AgCl? Составьте схему мицеллы. 17. Какой объем раствора FeCl3 с СЭК = 0,003 моль экв/л надо прибавить к 0,03 л раствора AgNO3 с СЭК = 0,002 моль экв/л, чтобы частицы золя AgСl в электрическом поле двигались к аноду (положительный электрод)? Составьте схему мицеллы. 18. Какой объем 0,001 М раствора АlСl3 надо прибавить к 0,02 л раствора Н2S с СЭК = 0,003 моль экв/л, чтобы образовался золь с отрицательно заряженными частицами? Составьте схему мицеллы. 19. Какой объем раствора KI с СЭК = 0,0025 моль экв/л надо прибавить к 0,035 л раствора Pb(NO3)2 с СЭК = 0,003 моль экв/л, чтобы получить золь РbI2 с отрицательно заряженными частицами? Составьте схему мицеллы золя. 20. Какой объем раствора NaOH с СЭК = 0,002 моль экв/л надо добавить к 0,003 л раствора Fe2(SO4)3 с СЭК = 0,0003 моль экв/л, чтобы получить золь Fe(ОН)3 с положительно заряженными частицами? Составьте схему мицеллы золя. 21 - 30. Для получения гидрофобного золя используется реакция между веществами А и Б, взятыми в виде растворов с концентрациями СА и СБ в объемах VА и VБ. Определите заряд частиц дисперсной фазы и составьте схему мицеллы (табл. 2.4). Таблица 2.4
31. Вычислите порог коагуляции золя раствором сульфата 32. Какой объем раствора FeСl3 с СЭК = 0,0002 моль экв/л потребуется для коагуляции 0,025 л золя сульфида мышьяка, если порог коагуляции FeСl3 33. Вычислите порог коагуляции золя раствором K2SO4, если добавление 0,002 л раствора K2SO4 с СЭК = 0,15 моль экв/л вызывает коагуляцию 0,02 л золя. 34. Какой объем раствора Сr(NО3)3 с СЭК = 0,0003 моль экв/л требуется для коагуляции 0,02 л золя сульфида мышьяка, если порог коагуляции Сг(NO3)3 35. Вычислите порог коагуляции золя раствором сульфата 36. В две колбы налито по 0,1 л золя гидроксида железа. 37. Частицы золя йодида серебра заряжены отрицательно. 38. В две колбы налито по 0,1 л золя гидроксида железа. 39. Порог коагуляции золя оксида мышьяка хлоридом алюминия равен 0,093 ммоль экв/л. Вычислите молярную концентрацию эквивалента СЭК раствора АlСl3, 0,0008 л которого хватило для коагуляции 0,125 л золя. 40. В две колбы налито по 0,1 л золя гидроксида алюминия. 41. Порог коагуляции золя оксида мышьяка нитратом железа 42. Для коагуляции 0,05 л золя сульфида мышьяка Аs2S3 в первом случае взяли 0,005 л раствора NН4Сl с СЭК = 2 моль экв/л, во втором - 0,005 л раствора Na2SO4 с СЭК = 0,03 моль экв/л. Рассчитайте, у какого из данных электролитов меньший порог коагуляции для золя Аs2S3 и определите знак заряда частиц золя. 43. Для коагуляции 0,05 л золя сульфида мышьяка Аs2S3 в первом случае взяли 0,0025 л раствора NаСl с СЭК. = 4 моль экв/л, во втором - 0,004 л раствора K3[Fe(CN)6] с СЭК = 0,0005 моль экв/л. Рассчитайте, у какого из данных электролитов меньший порог коагуляции и определите знак заряда частиц золя. 44. Для коагуляции 0,05 л золя сульфида мышьяка Аs2S3 в первом случае взяли 0,07 л раствора К2SO4 с СЭК. = 0,02 моль экв/л, во втором - 0,002 л раствора К3РО4 с СЭК. = 0,001 моль экв/л. Рассчитайте, у какого из данных электролитов меньший порог коагуляции для золя Аs2S3 и определите знак заряда частиц золя. 45. Порог коагуляции золя хлорида серебра хлоридом алюминия равен 0,41 ммоль экв/л. Какой объем раствора Аl(NO3)3 с СЭК = 0,001 моль экв/л нужно взять, чтобы вызвать коагуляцию 0,01 л этого золя? Варианты домашнего задания
Лабораторная работа «Получение и свойства коллоидных систем» Целью данной работыявляется ознакомление с различными способами получения коллоидных систем и с некоторыми их свойствами.
Опыт 1. Получение золя крахмала 1. Немного крахмала насыпьте в пробирку, прилейте воды, взболтайте и профильтруйте. 2. Немного крахмала насыпьте в ступку, добавьте небольшое количество воды, чтобы получилась густая кашица, и тщательно разотрите пестиком. Растертую кашицу разбавьте водой и профильтруйте через тот же фильтр, перенеся его в чистую пробирку. 3. К обоим фильтратам прибавьте по нескольку капель раствора йода. Что наблюдается? Чем объясняется окрашивание раствора? В какой из пробирок получился золь? Каким методом получен золь крахмала?
Опыт 2. Получение золя канифоли Небольшое количество спиртового раствора канифоли прибавьте по каплям к 10 мл воды в пробирке при постоянном взбалтывании до образования сильно опалесцирующего золя. Чем объясняется явление опалесценции в коллоидных системах? Каким методом получен золь канифоли?
Опыт 3. Получение и коагуляция золя гидрата окиси железа 1. Нагрейте 100 мл дистиллированной воды в колбе до кипения. 2. В кипящую воду прибавьте небольшими порциями 5 мл раствора FеСl3. Сравните окраску полученного золя с окраской исходного раствора FеСl3. Напишите уравнение реакции гидролиза, происходящего при взаимодействии FеСl3 с водой. 3. Налейте в 3 пробирки по 5 мл полученного золя Fе(ОН)3.
Таблица 2.5
Какой ион электролита является коагулянтом для золя Fe(ОН)3 в каждом из трех случаев? Какой заряд имеет частица золя гидрата окиси железа? Напишите схему мицеллы золя гидрата окиси железа.
Опыт 4. Определение порога коагуляции золяFе(ОН)3 Полученный в опыте 4 золь Fe(ОН)3 разлейте по 10 мл в пять нумерованных пробирок. В 1-ю пробирку прилейте с помощью пипетки 0,5 мл раствора Na2SO4 с СЭК = 0,002 моль экв/л, являющегося коагулянтом для данного золя. В каждую последующую пробирку прилейте на 0,5 мл раствора больше, чем в предыдущую, т.е. во 2 - ю пробирку - 1 мл, в 3 - ю – 1,5 мл и т.д., причем после добавления раствора соли пробирку встряхивайте до равномерного перемешивания смеси. Прибавляйте электролит, наблюдая, в какой из пробирок, т.е. от какого количества коагулянта, появится устойчивое помутнение, и через некоторое время произойдет явная коагуляция. Этот минимальный объем электролита и будет определять порог коагуляции данного золя в условиях опыта. Вычислите порог коагуляции.
Опыт 5. Взаимная коагуляция золей гидрата окиси железа и берлинской лазури 1. Налейте в колбу 50 мл дистиллированной воды, прибавьте 2. Налейте в пробирку 10 мл золя берлинской лазури и постепенно по стенке пробирки пипеткой добавьте такой же объем золя Fe(ОН)3. Не взбалтывайте! Осторожно поставьте пробирку в штатив и через некоторое время посмотрите. Что наблюдается? Какой заряд имеют частицы золя берлинской лазури? Напишите уравнение реакции получения золя берлинской лазури и составьте схему мицеллы.
Поиск по сайту: |
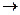
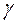 = 0,067 ммоль экв /л?
= 0,067 ммоль экв /л?