 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Что называется дисперсной фазой и дисперсионной средой в коллоидной системе?
2. Какие методы получения коллоидных систем вы знаете? 3. Почему происходит рассеяние света в коллоидных системах? 4. Из всякого ли вещества можно получить коллоидную систему, если дисперсионной средой является вода? 5. Лиофильные коллоидные системы. Примеры. Чем обусловливается их устойчивость? 6. Лиофобные коллоидные системы. Какое минимальное число компонентов необходимо для получения устойчивой лиофобной системы? 7. Чем обусловлена устойчивость лиофобных коллоидных систем? 8. Что называется коагуляцией? Механизм коагуляции в лиофильных и лиофобных системах.
Литература 1. Коровин Н.В. Общая химия. - М: Высш. шк., 2002. Гл. 8. 2. Глинка Н.Л. Общая химия. – М: Интеграл-Пресс, 2002. Гл.10. Индивидуальные задания для самостоятельной подготовки студентов Примеры решения задач Пример 1. Золь иодида серебра получен при добавлении к 0,01 л раствора KI с СЭК = 0,005 моль экв/л, 0,014 л раствора АgNО3 с СЭК = 0,0025 моль экв/л. Определите заряд частиц полученного золя и составьте схему его мицеллы.
Решение. При смешении растворов АgNО3 и KI протекает реакция
Аg NО3 + KI = АgI↓ + KNО3. Определяем число молей эквивалентов исходных реагентов:
АgNО3 : 0,0025 ∙ 0,014 = 3,5∙10-5 моль экв, KI : 0,005 ∙ 0,01 = 5∙10 -5 моль экв.
Из расчета видно, что в растворе имеется избыток KI, следовательно, ядром коллоидных частиц золя АgI будут адсорбироваться ионы I-, и частицы приобретут отрицательный заряд. Противоионами являются катионы К+. Схема мицеллы в данном случае такова:
{ [ АgI ]n , ∙ x I-, y K+ } – (x - y) ∙ (х - у) K+.
Пример 2. Какой объем раствора ВаСl2 с СЭК = 0,001 моль экв/л надо добавить к 0,02 л раствора Аl2(SO4,)3 с СЭК = 0,0003 моль экв/л, чтобы получить золь сульфата бария с положительно заряженными частицами? Напишите формулу мицеллы золя ВаSO4. Решение. Образование золя ВаSO4 происходит по реакции 3 ВаСl2 + Аl2(SO4)3 = 3 ВаSO4 ↓+ 2 АlСl3. Объем раствора хлорида бария, необходимый для достижения стехиометрического соотношения реагентов, равен
Для получения положительного заряда на частицах золя необходим избыток ионов бария, следовательно, для реакции надо взять больше, чем 6 мл раствора хлорида бария. Схема мицеллы в данном случае
{ [ВаS04] n∙ x Ва2+∙ y Cl-}+ (2x - y) ∙ (2х - у) Сl-.
Пример 3. В три колбы налито по 0,02 л золя хлорида серебра. Для коагуляции золя в первую колбу добавили 0,0085 л раствора NaСl с СЭК = 1 моль экв/л, во вторую – 0,017л раствора MgCl2 с СЭК = 0,01 моль экв/л, а в третью – 0,014 л раствора АlСl3 с СЭК = 0,001 моль экв/л. Вычислите пороги коагуляции золя этими электролитами и определите знак заряда частиц золя. Решение. Порог коагуляции вычисляем по формуле
Пороги коагуляции золя данными электролитами равны: NaCl : MgCl2 : АlСl3 : Добавляемые электролиты содержат один и тот же анион, но разные катионы. Наиболее эффективным коагулянтом является АlСl3, содержащий катион с наибольшим зарядом (у него наименьший порог коагуляции), поэтому можно заключить, что частицы золя заряжены отрицательно. Обратите внимание, что вычисленные пороги коагуляции приблизительно соответствуют правилу Шульце-Гарди. Пример 4. Порог коагуляции золя гидроксид алюминия, имеющего положительно заряженные частицы, нитратом калия равен 60 ммоль экв/л. Оцените порог коагуляции этого золя красной кровяной солью К3[Fe(СN)6]. Решение. Коагуляцию золя вызывает тот из ионов добавляемого электролита, заряд которого противоположен заряду коллоидной частицы (в данном случае - анион). Заряд аниона в нитрате калия равен -1, в красной кровяной соли К3[Fe(СN)6] – (-3). По правилу Шульце - Гарди пороги коагуляции одно-, двух- и трехзарядными ионами относятся как 729 : 11 : 1(приблизительно). Поэтому искомая оценка порога коагуляции данного золя красной кровяной солью 60 : 729 = 0,082 ммоль экв/л.
Поиск по сайту: |
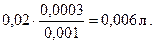
 .
. ммоль экв/л;
ммоль экв/л; ммоль экв/л;
ммоль экв/л; ммоль экв/л.
ммоль экв/л.