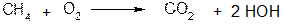|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сольватация (гидратация): Тепловой эффект растворения
Главную роль в образовании сольватов играют непрочные межмолекулярные силы и, в частности, водородная связь. Так, рассматривая механизм растворения вещества на примере NaCl в воде, было видно, что положительные и отрицательные ионы, имеющиеся в кристаллической решетке, могут по законам электростатического взаимодействия притягивать или отталкивать полярные молекулы растворителя. Например, положительно заряженные ионы Na+ могут быть окружены одним или несколькими слоями полярных молекул воды (гидратация ионов). Отрицательно заряженные ноны Сl- также могут взаимодействовать с молекулами полярного растворителя, но ориентация диполей воды вокруг ионов Сl- будет отличаться от ориентации вокруг ионов Na+ (см. рис.1). Кроме того, довольно часто растворяемое вещество может и химически взаимодействовать с растворителем. Например, хлор, растворяясь, реагирует с водой (хлорная вода) Сl2+Н20=НСl + НОСl Аммиак, растворяясь в воде, одновременно образует гидроксид аммония (точнее гидрат аммиака) NН3 + Н2O=NН3•Н2О↔Н4+ + OН- Как правило, при растворении поглощается или выделяется тепло и происходит изменение объема раствора. Объясняется это тем, что при растворении вещества происходит два процесса: разрушение структуры растворяемого вещества и взаимодействие частиц растворителя с частицами растворенного вещества. Оба эти процесса сопровождаются различными изменениями энергии. Для разрушения структуры растворяемого вещества требуются затраты энергии, тогда как при взаимодействии частиц растворителя с частицами растворенного вещества происходит выделение энергии. В зависимости от соотношения этих тепловых эффектов процесс растворения вещества может быть эндотермическим или экзотермическим. Тепловые эффекты при растворении различных веществ различны. Так, при растворении серной кислоты в воде выделяется значительное количество теплоты. Аналогичное явление наблюдается при растворении в воде безводного сульфата меди (экзотермические реакции). При растворении в воде нитрата калия или нитрата аммония температура раствора резко понижается (эндотермические процессы), а при растворении в воде хлорида натрия температура раствора практически не меняется. Исследование растворов различными методами показало, что в водных растворах образуются соединения частиц растворенного вещества с молекулами воды - гидраты. В случае сульфата меди присутствие гидратов легко обнаружить по изменению цвета: безводная соль белого цвета, растворяясь в воде, образует раствор синего цвета. Иногда гидратная вода настолько прочно связана с растворенным веществом, что при выделении его из раствора входит в состав его кристаллов. Кристаллические вещества, содержащие в своем составе воду, называются кристаллогидратами. Вода, входящая в структуру таких кристаллов, называется кристаллизационной.
Термохимия. Раздел химической термодинамики, посвященный исследованиям тепловых эффектов химических реакций, называют термохимией. Значение термохимии в практике весьма большое, если учесть, что тепловые эффекты рассчитывают при составлении тепловых балансов различных процессов и при исследовании химических равновесий. Термохимия позволяет вычислять тепловые эффекты процессов, для которых отсутствуют экспериментальные данные. Это относится не только к химическим реакциям, но и к процессам растворения, испарения, сублимации, кристаллизации и др. фазовым переходам. Тепловым эффектом химической реакции называют максимальное количество теплоты, которое выделяется или поглощается в необратимом процессе при постоянном объеме или давлении и при условии, что продукты реакции и исходные вещества имеют одинаковую температуру и отсутствуют другие виды работ, кроме расширения. Тепловой эффект считается положительным, когда теплота поглощается в ходе реакции (эндотермическая реакция), если теплота выделяется — отрицательным (экзотермическая реакция). Согласно закону Гесса, установленного экспериментально в 1846 г., - тепловой эффект процесса не зависит от промежуточных стадий процесса, а определяется лишь начальным и конечным состояниями системы.
Закон Гесса является вполне строгим только для процессов, протекающих при постоянном объеме, когда тепловой эффект равен ∆U (изменению внутренней энергии), или при постоянном давлении, когда тепловой эффект равен ∆Н (изменению энтальпии). δ Qv = dU , Qv = ΔU δ Qp = dH , Qp = ΔH Для этих процессов он легко выводится из общего первого начала термодинамики (закон Гесса был установлен раньше, чем было введено уравнение первого начала термодинамики). Выводы из закона Гесса: 1. Теплота образования соединения из исходных веществ не зависит от способа получения этого соединения. Тепловой эффект реакции равен алгебраической сумме теплот образования продуктов реакции минус алгебраическая сумма теплот образования исходных веществ, с учетом стехиометрического коэффициента. Теплота разложения соединения до тех же исходных веществ равна и противоположна по знаку теплоте образования соединения из этих веществ. Тепловой эффект разложения какого-либо химического соединения точно равен и противоположен по знаку тепловому эффекту его образования ΔНразл. = - ΔНобр.
3. Если из двух различных систем в результате различных процессов образовался одинаковый продукт, то разность между значениями тепловых эффектов этих процессов равна теплоте перехода из первой системы во вторую.
Следствия из закона Гесса: 1. Тепловой эффект реакции равен сумме теплот образования реагентов из простых веществ. Эта сумма разбивается на два слагаемых: сумма теплот образования продуктов (положительная) и сумма теплот образования исходных веществ (отрицательная) с учетом стехиометрических коэффициентов.
ΔHх.р. = ∑ (ΔHf νi )прод. - ∑(ΔHf νi)исх.
ΔHх.р. = ∑ (ΔHсгi · νi)исх. - ∑(ΔHсг · νi)пр.
ΔНх.р.= ΔНсг(СН4) - ΔНсг(СО2) - 2 ΔНсг(Н2О)
ΔНсг(О2) = 0
Таким образом, закон Гесса применяется при различных термохимических расчетах, и является основным законом термохимии. Он дает возможность вычислить тепловые эффекты процессов, для которых экспериментальные данные отсутствуют; тепловые эффекты реакций, протекающих в калориметре; для медленных реакций, т. к. теплота в ходе реакции будет рассеиваться, а во многих случаях и для таких, для которых они не могут быть измерены в нужных условиях, или когда процессы еще не осуществлялись. Это относится как к химическим реакциям, так и к процессам растворения, испарения, кристаллизации, адсорбции и др. Однако применение данного закона требует строгого соблюдения предпосылок, лежащих в его основе. Прежде всего, необходимо, чтобы в обоих процессах были действительно одинаковы начальные и конечные состояния. При этом существенным является не только одинаковость химического состава продуктов, но и условий их существования (температура, давление и др.) и агрегатного состояния, а для кристаллических веществ также и одинаковость кристаллической модификации. При точных расчетах в случае, если какое либо из веществ, участвующих в реакциях, находится в высокодисперсном (т. е. сильно раздробленном) состоянии, существенной оказывается иногда даже и одинаковость степени дисперсности веществ. Очевидно, что тепловой эффект будет различен также в зависимости от того, будут ли получаемые или исходные вещества находиться в чистом состоянии или в растворе, отличаясь на величину теплоты растворения. Тепловой эффект реакции, протекающей в растворе, равен сумме теплового эффекта самой реакции и теплового эффекта процесса растворения химических соединений в данном растворителе.
Поиск по сайту: |