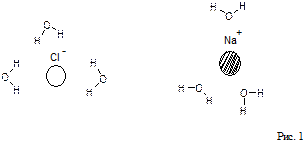|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Термодинамическая теория растворовСтр 1 из 6Следующая ⇒
Федеральное агентство по рыболовству ФГОУ ВПО «Астраханский государственный технический университет»
Кафедра «Органическая, биологическая и физколлоидная химия» (ОРХ)
Методическое указание к лабораторной работе: КАЛОРИМЕТРИЯ
Астрахань 2007г АВТОРЫ: кандидат химических наук, доцент кафедры органической, биологической и физколлоидной химии Стороженко Валентина Николаевна; кандидат химических наук, доцент кафедры органической биологической и физколлоидной химии Летичевская Наталья Николаевна; кандидат химических наук, доцент кафедры органической биологической и физколлоидной химии Шинкарь Елена Владимировна.
Методические указания рассмотрены и одобрены на заседании кафедры органической, биологической и физколлоидной химии 25.06.07г. протокол №7
РЕЦЕНЗЕНТ: кандидат химических наук, доцент кафедры органической биологической и физколлоидной химии Пащенко Константин Петрович ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
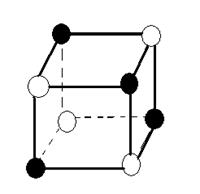
Растворами называются однофазные, гомогенные системы, содержащие не менее двух компонентов. Известны две основные теории растворов: физическая и химическая. Физическая теория растворов была предложена Якобом, Вант-Гоффом (1885 г.) и Сванте Аррениусом (1883 г.). Согласно этой теории растворитель рассматривается как химически индифферентная среда, в которой равномерно распределены частицы (молекулы, ионы) растворенного вещества. При этом предполагается отсутствие межмолекулярного взаимодействия, как между частицами растворенного вещества, так и между молекулами растворителя и частицами растворенного вещества. Частицы растворителя и растворенного вещества вследствие процессов диффузии перемешиваются и равномерно распределяются по всему объему раствора. Как выяснилось впоследствии, физическая теория удовлетворительно описывает поведение лишь малой группы растворов, так называемых идеальных растворов, в которых частицы растворителя и частицы растворенного вещества действительно практически не взаимодействуют между собой. Примерами идеальных растворов являются многие газовые растворы. Химическая или сольватная теория растворов предложена Д. И. Менделеевым (1887 г.). Менделеев, посвятивший исследованиям растворов более сорока лет, первым указал, что в реальном растворе могут существовать не только частицы растворенного вещества и растворителя (примерами таких растворов являются растворы водорода, кислорода, азота в воде, парафинов в жидких углеводородах), но часто может происходить химическое или физическое взаимодействие частиц растворяемого вещества с растворителем. Это легло в основу разработанной им теории растворов. Суть этой теории состоит в том, что между частицами растворенного вещества и молекулами растворителя происходит взаимодействие, в результате которого образуются нестойкие соединения переменного состава называемые сольватами или гидратами, если растворителем является вода. Процесс образования раствора можно показать на примере растворения твердого вещества в жидкости. С точки зрения молекулярно-кинетической теории растворение протекает следующим образом: при внесении в растворитель какого-либо твердого вещества, например поваренной соли, частицы ионов Na+ и Сl-, находящиеся на поверхности, в результате колебательного движения, увеличивающегося при соударении с частицами растворителя, могут отрываться и переходить в растворитель. Этот процесс распространяется и на следующие слои частиц, которые обнажаются в кристалле после удаления поверхностного слоя. Так постепенно частицы (ионы или молекулы), образующие кристалл переходят в раствор. На рис. 1 дана наглядная схема разрушения ионной кристаллической решетки NaСl при растворении в воде, состоящей из полярных молекул.
Частицы, перешедшие в раствор вследствие диффузии, распределяются по всему объему растворителя. С другой стороны, по мере увеличения концентрации, частицы (ионы, молекулы), находящиеся в непрерывном движении, при столкновении с твердой поверхностью еще не растворившегося вещества могут задерживаться на ней. Таким образом, растворение сопровождается всегда обратным процессом — кристаллизацией. Может наступить такой момент, когда одновременно выделяется из раствора столько же частиц (ионов, молекул), сколько их переходит в раствор, т.е. наступает равновесие
Термодинамическая теория растворов В ХХ веке обе теории были объединены в термодинамическую теорию растворов. Ее основная задача применить математический аппарат химической термодинамики для описания зависимости между свойствами раствора и составом раствора, а так же между свойствами раствора и свойствами чистого компонента. Как и любая термодинамическая теория, термодинамическая теория растворов абстрагируется от рассмотрения структуры частиц раствора и природы межмолекулярного взаимодействия.
Поиск по сайту: |
 Cl-
Cl-