 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Аспирационное устройство модель 822Стр 1 из 2Следующая ⇒
Список литературы
1.Основы аналитической химии.Кн.2. Методы химического анализа. Учебник для вузов / Под ред.Ю.А.Золотова.-М.:Высш.шк.,2002 – 494с. 2.Контроль за выбросами в атмосферу и работой газоочистных установок на предприятиях машиностроения: Практическое руководство/Н.Г.Булгакова, Л.С.Василевская, Л.Я.Градус и др.- М., Машиностроение, 1984 - 128с. 3.Перегуд Е. А., Горелик Д. О. Инструментальные методы контроля загрязнения атмосферы.– Л.: Химия, 1981.–384 с. 1.Общие положения 1.1. Метод абсорбции
В технике очистки газовых выбросов процесс абсорбции часто называют скрубберным процессом. Очистка газовых выбросов методом абсорбции заключается в разделении газовоздушной смеси на составные части путем поглощения одного или нескольких газовых компонентов (абсорбатов) этой смеси жидким поглотителем (абсорбентом) с образованием раствора. В случае образования химического соединения между абсорбтивом и абсорбентом процесс называют хемосорбцией. На этом основаны многие промышленные способы получения готового продукта (производства серной и соляной кислот). В отсутствие взаимодействия процесс называется физической абсорбцией. На обратимости физической абсорбции основано выделение поглощенного газа из раствора – десорбция (абсорбция ацетилена из газов крекинга, очистка топочных газов от диоксида серы). Сочетание абсорбции и десорбции позволяет многократно применять поглотитель и выделять поглощенный газ в чистом виде (очистка коксового и нефтяного газов от сероводорода). Движущей силой здесь является градиент концентрации на границе фаз газ – жидкость. Растворенный в жидкости компонент газовоздушной смеси (абсорбат) благодаря диффузии проникает во внутренние слои абсорбента. Процесс протекает тем быстрее, чем больше поверхность раздела фаз, турбулентность потоков и коэффициенты диффузии, т. е. в процессе проектирования абсорберов особое внимание следует уделять организации контакта газового потока с жидким растворителем и выбору поглощающей жидкости (абсорбента). Решающим условием при выборе абсорбента является растворимость в нем извлекаемого компонента и ее зависимость от температуры и давления. Если растворимость газов при 0°С и парциальном давлении 101,3 кПа составляет сотни граммов на 1 кг растворителя, то такие газы называют хорошо растворимыми Для удаления из технологических выбросов таких тазов, как аммиак, хлористый или фтористый водород, целесообразно применять в качестве поглотительной жидкости воду, так как растворимость их в воде составляет сотни граммов на 1 кг Организация контакта газового потока с жидким растворителем осуществляется либо пропусканием газа через насадочную колонну, либо распылением жидкости, либо барботажем газа через слой абсорбирующей жидкости. В зависимости от реализуемого способа контакта газ – жидкость аппаратное оформление процесса различно.
1.2.Отбор проб воздуха через поглотительные приборы Перед отбором пробы знакомятся с технологическим процессом и устанавливают, в каком агрегатном состоянии может находиться вещество в воздухе (газ, пар, аэрозоли), какие вещества сопутствуют ему, кратковременно или непрерывно поступает это вещество в анализируемый воздух. Для отбора проб используют прямые и изогнутые под прямым углом газозаборные трубки из стекла, легированной стали, меди, тефлона, полихлорвинила, полипропилена и других материалов в зависимости от агрессивности анализируемых веществ. Отбор проб воздуха для определения содержания весьма малых концентраций вредных веществ проводят чаще всего аспирационным способом, основанным на пропускании известного объема воздуха через какой-либо поглотительный раствор. Вещества в газо- и парообразном состоянии поглощаются из воздуха жидкими средами, в которых они растворяются или химически связываются. Объемный расход воздуха через поглотительные приборы устанавливают заранее экспериментально для каждого метода отдельно. Для аспирации анализируемого воздуха через поглотительные приборы используют электрические или водяные аспираторы, подробное описание которых дано в различных методических руководствах. Там же даны рекомендации по применению поглотительных приборов для отбора представительных проб воздуха в зависимости от условий. Наиболее широкое применение для исследования состава промышленных вентиляционных выбросов нашли поглотители, изображенные на рис.1-5.
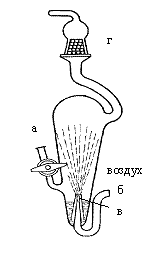
Рис.1. Поглотительные приборы: а – Зайцева, б – Петри, в – Полежаева
Рис.2. Поглотительные приборы: а – модернизированный Зайцева, б – Рихтера
Рис.3. а – поглотительные приборы для зерненых сорбентов в "кипящем " слое: 1 - стеклянная пористая пластинка N 1, 2 - перфорированный шарик, б – Поглотительный прибор Яворовской .
Рис.4. Поглотительный прибор Зайцева (видоизмененный) для зерненных сорбентов в "кипящем" слое
Рис.5. Поглотительный прибор Гернет: а - боковая трубка, б - нижняя трубка, в - распылитель, г – брызгоуловитель
В процессе длительного отбора проб растворитель (поглотительный раствор) часто испаряется и объем поглотительной среды уменьшается. Для поддержания постоянного объема пробы в процессе отбора растворитель периодически добавляют (до начального объема). Уменьшить испарение растворителя можно, поместив поглотительные приборы в охладительную смесь. Известным достижением в области отбора проб воздуха является поглощение малых концентраций токсичных примесей ультратонкой пленкой химических абсорбентов, наносимых на инертный субстрат – измельченное стекло (стеклянную крупку). Достоинствами пленочных улавливателей (рис.6) в сравнении c жидкостными поглотителями являются большая скорость аспирации исследуемого воздуха и удобство применения в полевых условиях .
Рис.6. Пробирка с пленочным улавливателем и сетчатым дном: 1- пробка из целлофана, 2 - стеклянная крупка, 3 - целлофан с резиновым кольцом-держателем При отборе проб в условиях пониженных температур окружающего воздуха применяют обогреватели (рис.7).
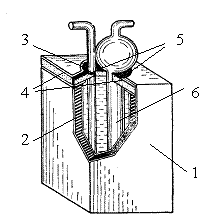
Рис.7. Обогреватель с помещенным в него поглотителем: 1 - пластмассовый корпус, 2 - теплоизолирующий сосуд, 3 - двойное круглое отверстие, 4 - микропористая резиновая пластинка, 5 - два отверстия в пластинке, 6 поглотитель
Если выбранный метод анализа позволяет ограничиться небольшим объемом воздуха, пробы отбирают в бутыли вместимостью 2—3 л или в газовые пипетки. При этом отбор проб воздуха осуществляют несколькими способами; выливают жидкость (воду или солевой раствор), которой перед отбором пробы наполняют доверху бутыль или газовую пипетку; продувают через сосуд 10-кратным объемом анализируемого воздуха (способ обмена). Во избежание конденсации паров исследуемого вещества на стенках сосуда применяют вакуумную продувку (с объемным расходом не менее 2 л/мин). При этом используют сосуды из толстого стенного стекла, защищенные чехлом из металлической сетки. Газовую пипетку или бутыль подсоединяют к тройнику вакуумметра. Второй конец тройника подсоединяют к вакуумному насосу. Откачивают воздух из емкости до остаточного давления 1,3–3 кПа. В месте отбора пробы вакуумированный сосуд соединяют с газозаборной трубкой, вставленной в воздуховод, и на 10–20 с открывают кран для впуска исследуемого воздуха в сосуд. Сосуд выдерживают в помещении для выравнивания температур отобранного воздуха и окружающей среды. Затем с помощью открытого ртутного манометра измеряют давление в сосуде с отобранной пробой.
1.3. Ионометрический МЕТОД ИЗМЕРЕНИЯ
Электрохимические методы анализа основаны на использовании ионообменных или электрообменных процессов, протекающих на поверхности электрода или в приэлектродном пространстве. В основе прямых потенциометрических определений лежит зависимость равновесного потенциала электрода от активности (концентрации) определяемого иона. Для измерений необходимо иметь гальванический элемент и прибор для измерения аналитического сигнала. Гальванический элемент состоит из двух электродов: индикаторного и электрода сравнения, погруженных в один сосуд с раствором. В потенциометрии в качестве индикаторных часто используют ионоселективные электроды. В методе применяют мембранные (ионоселективные) индикаторные электроды (ИСЭ). Важнейшей составной частью этих электродов является полупроницаемая мембрана – тонкая пленка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого и обладающая способностью пропускать преимущественно ионы только одного вида. Механизм возникновения мембранного потенциала. Способность мембраны быть проницаемой для ионов определенного знака заряда обусловлена наличием ионогенных групп. Если мембрана контактирует с двумя растворами иона
Активность ионов A+ во внутреннем растворе постоянна, поэтому
потенциал мембранного электрода линейно зависит от логарифма активности иона Любая мембрана в той или иной мере проницаема для всех ионов, находящихся в растворе, и поэтому необходимо учитывать влияние посторонних ионов, например В+, на потенциал электрода. Ионы B+ проникают в фазу мембраны в результате реакции обмена
Константа равновесия этой реакции (константа обмена, Потенциал мембранного электрода в растворе, содержащем кроме определяемого иона
где const – константа, зависящая от значений стандартных потенциалов внутреннего и внешнего электродов сравнения и от природы мембраны;
Основными характеристиками ионоселективного электрода являются электродная функция, селективность и время отклика. Электрод имеет нернстовскую электродную функцию в интервале активности (концентрации), где зависимость потенциала от
Рис. 8. Интервал выполнения электродной функции и предел обнаружения ионселективного электрода
точка перегиба на графике характеризует практическую величину предела обнаружения. Селективность электрода определяется величиной Величину пересечения потенциала электрода в растворах с постоянной концентрацией мешающего иона
Рис.9. Определение коэффициента селективности методом смешанных растворов ( Время отклика (время установления стационарного потенциала) определяют по зависимости потенциала от времени с момента погружения в анализируемый раствор, оно может колебаться от нескольких секунд до нескольких минут. Время достижения постоянного потенциала зависит от методики работы и величины концентрации раствора. Данный параметр очень важен при проведении автоматизированных анализов.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. СРЕДСТВА ИЗМЕРЕНИЙ, ВСПОМОГАТЕЛЬНЫЕ УСТРОЙСТВА, РЕАКТИВЫ И МАТЕРИАЛЫ
Приборы, аппаратура, посуда Ииономер И–500 Мешалки магнитные типа ММ-2 или аналогичные Электрод ионоселективный “Элит–051” Электрод вспомогательный хлорсеребряный ЭВП-1mB ГОСТ 5.1582-72, снабженный электролитическим ключом Аспирационное устройство модель 822 Поглотительные приборы Зайцева Колбы мерные вместимостью 50-100мл ГОСТ 1770-74 Пипетки вместимостью 10,25мл без делений с одной отметкой и вместимостью 5,10,20мл с делениями ГОСТ 20292-74 Груша резиновая вместимостью 200мл Стаканы химические вместимостью 50 мл высокие с носиком Цилиндры мерные вместимостью 100-250мл ГОСТ 1770-74 Пинцет Фильтровальная бумага марки “синяя лента” Реактивы, растворы и материалы Аммоний хлористый ГОСТ 3773-72 х.ч. высушенный до постоянной массы при 100-1050С 0,1М раствор Сульфат магния 1М раствор Серная кислота 0,2 Н раствор
Поиск по сайту: |
 . Если растворяются доли грамма вещества, то их называют плохо растворимыми
. Если растворяются доли грамма вещества, то их называют плохо растворимыми  .
. . При поглощении же из газов сернистого ангидрида или хлора расход воды будет значительным, так как растворимость их составляет сотые доли грамма на 1 кг воды. В некоторых специальных случаях вместо воды применяют водные растворы таких химических веществ, как сернистая кислота (для улавливания водяных паров), вязкие масла (для улавливания ароматических углеводородов из коксового газа) и др.
. При поглощении же из газов сернистого ангидрида или хлора расход воды будет значительным, так как растворимость их составляет сотые доли грамма на 1 кг воды. В некоторых специальных случаях вместо воды применяют водные растворы таких химических веществ, как сернистая кислота (для улавливания водяных паров), вязкие масла (для улавливания ароматических углеводородов из коксового газа) и др.




 с активностями
с активностями  (анализируемый раствор) и
(анализируемый раствор) и 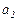 (внутренний раствор), то и на внешней и на внутренней сторонах мембраны происходит обмен ионами. Из-за различия активностей ионов
(внутренний раствор), то и на внешней и на внутренней сторонах мембраны происходит обмен ионами. Из-за различия активностей ионов  и
и 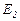 . С помощью электродов сравнения, помещенных во внешний и внутренний растворы, можно измерить разность
. С помощью электродов сравнения, помещенных во внешний и внутренний растворы, можно измерить разность 
 (1)
(1) (2) –
(2) – в анализируемом растворе.
в анализируемом растворе.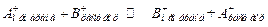 (3)
(3) ) зависит от природы мембраны и природы иона
) зависит от природы мембраны и природы иона  . Подвижности ионов
. Подвижности ионов  в фазе мембраны различны, поэтому возникает диффузионный потенциал, вносящий определенный вклад в величину
в фазе мембраны различны, поэтому возникает диффузионный потенциал, вносящий определенный вклад в величину  .
. и другие, описывается модифицированным уравнением Нернста (уравнением Никольского-Эйземана):
и другие, описывается модифицированным уравнением Нернста (уравнением Никольского-Эйземана): ,(4)
,(4) – активности и заряды основного (потенциалоопределяющего) и постороннего ионов соответственно;
– активности и заряды основного (потенциалоопределяющего) и постороннего ионов соответственно; - потенциометрический коэффициент селективности.
- потенциометрический коэффициент селективности. линейна и имеет угловой коэффициент
линейна и имеет угловой коэффициент  мВ (250С). Протяженность этого интервала зависит от природы мембраны. При очень низких концентрациях (для хороших электродов порядка 10–16 М) электрод утрачивает электродную функцию (рис.8);
мВ (250С). Протяженность этого интервала зависит от природы мембраны. При очень низких концентрациях (для хороших электродов порядка 10–16 М) электрод утрачивает электродную функцию (рис.8);
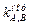 . Если этоткоэффициент меньше 1, то электродселективен относительно ионов
. Если этоткоэффициент меньше 1, то электродселективен относительно ионов  . Чем меньше величина
. Чем меньше величина  и переменной концентрацией определяемого иона
и переменной концентрацией определяемого иона  , по которой определяют
, по которой определяют 

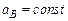 )
)