 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Период полупревращения для реакций 2-ого порядкаСтр 1 из 2Следующая ⇒
Влияние концентрации на скорость реакции По теории вероятностей: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них. Для протекания реакции: A + B→ K + L необходимо: · одновременное нахождение А и В в определённой точке реакционного пространства; · удачное их столкновение Вероятность (ω) нахождения молекулы для каждого из веществ прямо пропорциональна его концентрации: ωA = α×CаA, ωB = β×C вB. Вероятность одновременного нахождения обеих молекул в одной точке пространства, т.е. их столкновения: ω = ωA × ωB = α×Cа A × β×Cв B. γ – доля удачных столкновений
k -константа скорости: а) не зависит от концентрации б) зависит от температуры и природы реагирующих веществ. k – удельная скорость Þ а,в – частные порядки реакции по веществам А и В (определяются экспериментально) n = (а + в) – общий порядок реакции В простых (элементарных актах) реакциях: n = 1, 2 редко 3. В сложных реакциях:n = 0, целочисленные, дробные, (-),(+) Молекулярность:
Целое (+) число: 1,2, реже 3 1 – мономолекулярные: I2 ® 2I 2 – бимолекулярные: H2 + I2 ® 2HI 3 – тримолекулярные: 2NO + Cl2 ® 2NOCl
а) H2 + I2 ® 2HI – простая (элементарная) реакция n(Н2) = 1, n(I2) =1 ,т.е. равны стехиометрическим коэффициентам. n = 1+1 =2 Þ
б) 2N2O5 ® O2 + 2N2 O4 - сложная реакция протекает по стадиям: 1. N2O5 ® O2 + N2O3; 2. N2O3 ® NO + NO2; 3. 2NO2 ® N2O4 . и самая медленная стадия – (2) Þ она определяет порядок кинетического уравнения:
Механизм: 1ст.: Na2S2O3 +H2SO4 = H2S2O3 + Na2SO4 быстро 2ст.: H2S2O3 = S + H2SO3 - медленно Реакции 1-ого порядка
Кинетическое уравнение реакции первого порядка
Разделим переменные и проинтегрируем
lnC – lnC0 = -kt Þ lnC = lnC0 - kt С0 – исходная концентрация С - концентрация в момент времени t
Кинетическая кривая реакций 1-ого порядка
lgCo tga = - a
t, с
период полупревращения τ1/2:
C = 0,5C0 Þ
Реакции 2-ого порядка
A + B → продукты или 2А ® продукты
пусть C0A = C0B
разделим переменные и проинтегрируем:
Кинетическая кривая реакций 2-ого порядка
a tga = k 1/C0
t
Период полупревращения для реакций 2-ого порядка C = ½ C0
t ½ - обратно пропорционально начальной С0
Реакции 0-ого – порядка: С = С0 - kt ; t1/2 = С0 /2k
Реакции 3-его порядка:
Поиск по сайту: |




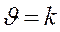 , если СА = СВ = 1моль/л
, если СА = СВ = 1моль/л

 Опыт: 5Na2SO3 + 2HJO3
Опыт: 5Na2SO3 + 2HJO3  J2 + 5Na2SO4 + H2O
J2 + 5Na2SO4 + H2O ;
;  ;
; 

 ; (x+y)lg1,4 = lg2; x+y =
; (x+y)lg1,4 = lg2; x+y =  @ 2
@ 2 Лаб.раб.: Na2S2O3 +H2SO4 = S + H2SO3 + Na2SO4
Лаб.раб.: Na2S2O3 +H2SO4 = S + H2SO3 + Na2SO4 А В CH3OCH3® CH4 + H2 + CO
А В CH3OCH3® CH4 + H2 + CO .
. 

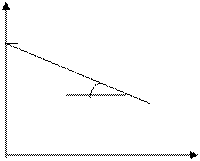 lgC
lgC
 или
или  . [ k]=[с-1]
. [ k]=[с-1] .
.
 - не зависит от Со
- не зависит от Со

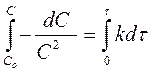

 [л×моль-1×с-1]
[л×моль-1×с-1]
 1/C
1/C

 ;
; 