 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Зависимость константы равновесия от температуры. Изобара химической реакции ⇐ ПредыдущаяСтр 5 из 5
Резкое возрастание скорости (константы скорости) химических реакций при повышении температуры очевидно и объяснимо за счет резкого увеличения числа активных соударений. Для обратимых реакций следует учитывать, что скорости прямой и обратной реакции тоже возрастают при повышении Т. При этом константа равновесия Kp = может оказаться как убывающей, так и возрастающей функцией температуры, в зависимости от того, какая константа возрастает сильнее. Как следует из уравнения Аррениуса (6.7.3), температурная зависимость константы скорости определяется величиной энергии активации: чем она больше тем сильнее эта зависимость, из этого следует, что для эндотермических реакций (энергия активации больше экзотермической на величину ΔН). Поэтому для эндотермических и экзотермических (прямых) реакций константа равновесия должна по разному зависеть от темепературы. Эту температурную зависимость определяют уравнения изобары и изохоры химических реакций. Первая – при протекании реакции при Р=const., вторая при V= const. Изобару химической реакции в дифференциальной форме можно записать так: (6.14), а изохору:
Решая эти уравнения при допущении, что тепловые эффекты реакций не изменяются в небольшом температурном интервале, получаем для изобары:
для изохоры:
Соотношения 6.14- 6.17 показывают, что температурная зависимость константы скорости определяется знаком ΔН или ΔU, так при экзотермической реакции (ΔН<0), константа равновесия при повышении температуры будет убывать, и наоборот для эндотермической (ΔН>0) возрастать, что и объясняет принцип Ле- Шателье. Выводы: 1. Все химические превращения по разному протекают во времени. 2. Большинство процессов обратимы. 2.1. В определенных условиях можно рассматривать реакцию как одностороннюю. 3. Скорость процессов зависит от внутренних и внешних факторов. 3.1. Внутренние – природа реагирующих веществ (определяется энергией активации). 3.2. Внешние: - температура; - концентрация; - давление. 4. Изменяя условия, можно регулировать скорость процесса. 5. Для обратимых реакций положение равновесия определяется внешними условиями и описывается константой равновесия. 6. Положение равновесия можно смещать, изменяя эти условия.
Поиск по сайту: |
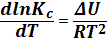 (6.15)
(6.15) (6.16),
(6.16), (6.17)
(6.17)