 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Молекулярность и порядок реакцииСтр 1 из 2Следующая ⇒
ХИМИЧЕСКАЯ КИНЕТИКА
Скорость реакции
Химическая кинетика изучает скорость и механизм протекания химических реакций. Различают два типа химических реакций: гомогенные и гетерогенные. К гомогеннымотносятся реакции, у которых и исходные вещества и продукты реакции находятся в одной фазе. Взаимодействие веществ в таких реакциях происходит по всему объёму. К гетерогеннымреакциям относят реакции, протекающие на границе раздела фаз. Пусть протекает реакция
где a1, a2, ai, b1, b2, bj – стехиометрические коэффициенты. Скорость реакции по i – му веществу в гомогенной системе определяется как количество i- го вещества, образующееся в единице реакционного объёма в единицу времени:
где V – объём реакционной зоны; Ni – количество i – го вещества. Если реакция протекает изохорически, то поскольку концентрация и объём связаны соотношением
получим
Размерность скорости: моль/(л·с). Экспериментально установлено, что скорость реакции зависит от природы реагирующих веществ, их концентрации или давления, температуры, т.е.
Раскрытие этой зависимости и составляет одну из задач кинетики.
Влияние концентрации на скорость реакции
Пусть протекает химическая реакция, записанная в общем виде: aA + bB + …→продукты. (*) Тогда зависимость скорости реакции от концентрации можно выразить соотношением
Полученное выражение называют законом действия масс (Гульберт и Вааге, 1864 г.)
Молекулярность и порядок реакции
Число молекул, вступающих в реакцию, определяют молекулярность реакции. Так, если в реакцию вступает одна молекула, то такая реакция называется молекулярной реакцией. Если в реакции участвуют две молекулы (безразлично, одинаковые или нет), то такая реакция называется бимолекулярной. Встречаются также тримолекулярные реакции. Реакции более высокой степени молекулярности крайне редки из – за малой вероятности одновременного столкновения большого числа молекул. Поэтому большинство реакций протекают в несколько элементарных, простых стадий, в которых участвует небольшое число молекул. Скорость всей реакции определяется скоростью её наиболее медленной стадии, которая и определяет механизм. Поэтому уравнение (1.4а) справедливо только для таких элементарных стадий. Молекулярность реакции легко определить в случае простых реакций, протекающих в одну стадию. В большинстве же случаев довольно трудно найти молекулярность реакции. Поэтому вводится понятие порядка реакции, который определяется экспериментально. Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции:
v = kСnA СmB , (1.4 в) где n, m – порядок реакции по веществу А и В. l = n+m – суммарный порядок реакции.
Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода: H2 + I2 ® 2HI. Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции
В подавляющем большинстве случаев порядок реакции по веществу отличается от стехиометрических коэффициентов уравнения реакции для этого вещества. Соответственно общий порядок реакции обычно не равен сумме стехиометрических коэффициентов уравнения реакции. Например, для реакции 2N2O5 ® O2 + 2N2 O4 порядок реакции по N2O5 равен не двум, а единице. Это обусловлено тем, что реакция протекает по стадиям: 1. N2O5 ® NO2 + NO3; 2. NO3 ® NO + NO2; 3. NO + NO3 ® 2NO2. Причём самая медленная стадия – вторая. Именно поэтому реакция разложения N2O5 имеет экспериментально определённый первый порядок, т.е.
Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, называют кинетическим. К сожалению, кинетическое уравнение реакции может быть получено только при её экспериментальном изучении и не может быть выведено из стехиометрического уравнения реакции.
Поиск по сайту: |
 (1.1)
(1.1) (1.2)
(1.2)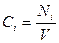
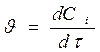 . (1.3)
. (1.3) .
.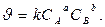 (1.4а)
(1.4а)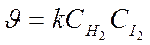 .
.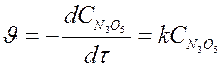 .
.