|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Активность воды и стабильность пищевых продуктов
С учетом вышесказанного ясно, что стабильность пищевых продуктов и активность воды тесно связаны. На рис. 10.8 показано отношение между aw и скоростью различных реакций, происходящих в пищевых продуктах при температуре 25—45°С. Для сравнения здесь же представлена изотерма сорбции. Нужно помнить, что точная скорость реакции, наклон кривых и т. д. могут несколько изменяться в зависимости от состава, физического состояния, структуры образца, состава атмосферы (особенно присутствия кислорода), температуры, эффекта гистерезиса. В продуктах с низкой влажностью могут происходить окисление жиров, неферментативное потемнение, потеря водорастворимых веществ (витаминов), порча, вызванная ферментами. Активность микроорганизмов здесь подавлена. В продуктах с промежуточной влажностью могут протекать разные процессы, в том числе с участием микроорганизмов. В процессах, протекающих при высокой влажности, микроорганизмам принадлежит решающая роль. Для большинства химических реакций, показанных на рис. 10.8, большая или максимальная скорость имеет место, как правило, в области aw, характерной для продуктов с промежуточной влажностью (0,7—0,9). Минимальная скорость этих реакций на кривой изотермы наблюдается на границе зон I и II (aw= 0,2—0,4), и для всех реакций, кроме окисления липидов, скорость остается минимальной, если aw еще меньше. Влагосодержание, соответствующее этому состоянию, составляет мономолекулярный слой. Окисление липидов начинается при низкой aw По мере ее увеличения скорость окисления уменьшается примерно до границы зон I и II на изотерме, а затем снова увеличивается до границы зон II и III. Дальнейшее увеличение aw снова уменьшает скорость окисления (на рис. 10.8 не показано). Эти изменения можно объяснить тем, что при добавлении воды к сухому материалу сначала имеет место столкновение с кислородом. Эта вода (зона I) связывает гидропероксиды, сталкивается с их продуктами распада и, таким образом, препятствует окислению. Кроме того, добавленная вода гидратирует ионы металлов, которые катализируют окисление, уменьшая их действенность. Добавление воды за границей I—II приводит к увеличению скорости окисления. Предполагается, что вода, добавленная в этой области изотермы, может ускорять окисление путем увеличения растворимости кислорода и набухания макромолекул. При еще больших значениях aw
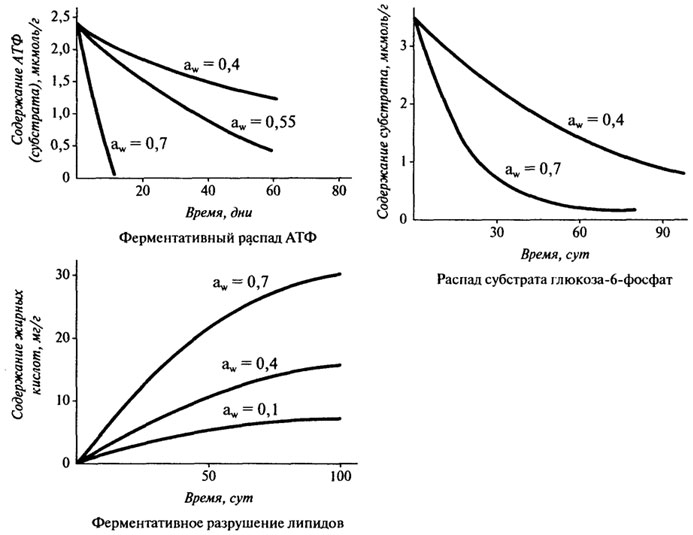
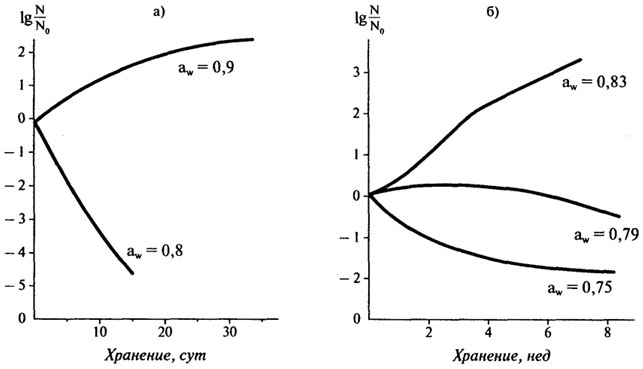
(больше, чем 0,8) имеет место уменьшение скорости окисления, что можно объяснить разбавлением катализаторов, приводящим к уменьшению их действия. На модельных системах (глюкоза—глицин, глюкоза—лизин) показано влияние aw на реакцию неферментативного потемнения. При aw=0,75 и температуре 40°С продолжительность реакции потемнения составляет 40 часов (глюкоза—лизин); при aw= 0,55 и температуре 40°С — 192 часа (глюкоза—глицин). Максимум потемнения наблюдается при aw= 0,6-0,75. Наблюдаемый максимум потемнения может объясняться наступлением равновесия в процессе диффузии, которая регулируется величиной вязкости, степенью растворения и массообменом. При низкой активности воды медленная диффузия реагентов замедляет скорость реакции. По мере увеличения влагосодержания более свободная диффузия ускоряет реакцию до тех пор, пока в верхней точке диапазона влажности растворение реагентов снова не замедляет ее. Точно так же более высокая концентрация воды замедляет ход реакции на тех обратимых стадиях, на которых образуется вода. Ферментативные реакции могут протекать при более высоком содержании влаги, чем влага монослоя, т.е. тогда, когда есть свободная вода. Она необходима для переноса субстрата. Учитывая это, легко понять, почему скорость ферментативных реакций зависит от aw. При aw, соответствующей влаге монослоя, нет свободной воды для переноса субстрата. Кроме того, в ряде ферментативных реакций вода сама играет роль субстрата. На рис. 10.9 показано влияние aw на ферментативные процессы в сублимированной говядине при ее хранении. Распад АТФ и глюкоза-6-фосфата существенно увеличивается при увеличении aw от 0,4 до 0,7. Ферментативные процессы под действием липаз имели место даже при aw = 0,1—0,2. Это, по-видимому, связано с тем, что липиды в меньшей степени нуждаются в воде как транспортном средстве, ибо подвижность самих липидов достаточна, чтобы образовать фермент-субстратный комплекс. В табл. 10.6 приведены предельные значения aw для роста микроорганизмов (средние данные по разным источникам). Для большинства бактерий предельное значения aw= 0,9, но, например, для St.aureus aw= 0,86. Этот штамм продуцирует целый ряд энтеротоксинов типа А, В, С, D, Е. Большинство пищевых отравлений связаны с токсинами А и D. Дрожжи и плесени могут расти при более низких значениях активности воды. При хранении пищевых продуктов активность воды оказывает влияние на жизнеспособность микроорганизмов (рис. 10.10). Поэтому активность воды в продукте имеет значение для предотвращения его микробиологической порчи.
Таблица 10.6.Предельные значения aw для роста микроорганизмов, встречающихся в пищевых продуктах
* Некоторые штаммы В основном порчу продуктов с промежуточной влажностью вызывают дрожжи и плесени, меньше — бактерии. Дрожжи вызывают порчу сиропов, кондитерских изделий, джемов, сушеных фруктов; плесени — мяса, джемов, пирожных, печенья, сушеных фруктов (табл. 10.7). Эффективным средством для предупреждения микробиологической порчи и целого ряда химических реакций, снижающих качество пищевых продуктов при хранении, является снижение активности воды в пищевых продуктах (рис. 10.10). Для снижения активности воды используют такие технологические приемы, как сушка, вяление, добавление различных веществ (сахар, соль и др.), замораживание. С целью достижения той или иной активности воды в продукте можно применять такие технологические приемы, как: — адсорбция — продукт высушивают, а затем увлажняют до определенного уровня влажности; — сушка посредством осмоса — пищевые продукты погружают в растворы, активность воды в которых меньше активности воды пищевых продуктов (рис. 10.11). Часто для этого используют растворы Сахаров или соли. В этом случае имеет место два противотока: из раствора в продукт диффундирует Таблица 10.7.Активность воды и рост микроорганизмов в пищевых продуктах [Fennema, 1985]
растворенное вещество, а из продукта в раствор — вода. К сожалению, природа этих процессов сложна, и в литературе нет достаточных данных по этому вопросу. Для достижения требуемой активности воды добавляют различные ингредиенты в продукт, обработанный одним из указанных выше способов, и дают ему возможность прийти в равновесное состояние, т.к. один лишь процесс сушки часто не позволяет получить нужную консистенцию. Применяя увлажнители, можно увеличить влажность продукта, но снизить aw. Потенциальными увлажнителями для пищевых продуктов являются крахмал, молочная кислота, сахара, глицерин и др. В табл. 10.8 приведены данные о содержании влаги в некоторых потенциальных увлажнителях пищевых продуктов при трех уровнях активности воды. Таблица 10.8.Содержание влаги в некоторых продуктах при комнатной температуре
На рис. 10.12 показано влияние наличия увлажнителей, снижающих активность воды, на реакцию неферментативного потемнения. Помимо влияния на химические реакции и рост микроорганизмов, активность воды имеет значение и для текстуры продуктов. Например, максимальная активность воды, допустимая в сухих продуктах без потери желаемых свойств, может изменяться в пределах 0,35—0,5 в зависимости от вида продукта (сухое молоко, крекеры, инстант-продукты и т.п.).
Большая aw необходима для продуктов мягкой текстуры, которые не должны обладать хрупкими свойствами. 480 :: 481 :: 482 :: 483 :: 484 :: 485 :: 486 :: 487 :: Содержание 487 :: 488 :: 489 :: Содержание 10.4. РОЛЬ ЛЬДА В ОБЕСПЕЧЕНИИ Замораживание является наиболее распространенным способом консервирования (сохранения) многих пищевых продуктов. Необходимый эффект при этом достигается в большей степени от воздействия низкой температуры, чем от образования льда. Образование льда в клеточных структурах пищевых продуктов и гелях имеет два важных следствия: а) неводные компоненты концентрируются в незамерзающей фазе (незамерзающая фаза существует в пищевых продуктах при всех температурах хранения) и б) вся вода, превращаемая в лед, увеличивается ~ на 9% в объеме. Во время замораживания вода переходит в кристаллы льда различной, недостаточно высокой степени чистоты. Все неводные компоненты поэтому концентрируются в уменьшенном количестве незамерзшей воды. Благодаря этому эффекту, незамерзшая фаза существенно изменяет такие свойства, какрН, титруемая кислотность, ионная сила, вязкость, точка замерзания, поверхностное натяжение, окислительно-восстановительный потенциал. Структура воды и взаимодействие "вода—растворенное вещество" также могут сильно изменяться. Эти изменения могут увеличить скорости реакций. Таким образом, замораживание имеет два противоположных влияния на скорость реакций: низкая температура как таковая будет ее уменьшать, а концентрирование компонентов в незамерзшей воде — иногда увеличивать (табл. 10.9). Так, в раде исследований показано увеличение при замораживании скорости реакций неферментативного потемнения, имеющих место при различных реакциях. Таблица 10.9.Влияние температуры и концентрирования растворенного вещества при замораживании на скорость реакций
Ускорение процессов неферментативного потемнения при замораживании представлено ниже:
Фактор возможности увеличения скорости различных реакций в замороженных продуктах необходимо учитывать при их хранении, поскольку этот фактор будет влиять на качество продукта (табл. 10.10). Многочисленными исследованиями показано, что существенное снижение скорости реакций (более чем в 2 раза) имеет место при Таблица 10.10. Примеры увеличения скорости ферментативных реакций при замораживании
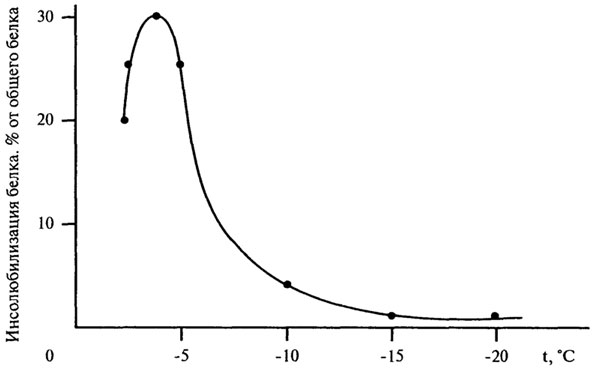
хранении пищевых продуктов в условиях достаточно низкой температуры (-18°С). На рис. 10.13 иллюстрируется, как изменяется такой важный показатель для качества пищевых продуктов, как инсолюбилизация белка, в течение 30 дней в зависимости от температуры.
При отрицательных температурах, достаточно близких к температуре замерзания воды (0°С) имеет место увеличение доли несолюбили-зованного белка. При температуре — 18°С инсолюбилизация белка уменьшается существенно, и это создает оптимальные условия для хранения продуктов. * Солюбилизация (коллоидное растворение) - проникновение низкомолекулярного вещества внутрь мицелл поверхностно-активного вещества или макромолекулярных клубков полимера. 487 :: 488 :: 489 :: Содержание 490 :: Содержание 10.5. МЕТОДЫ ОПРЕДЕЛЕНИЯ ВЛАГИ
Поиск по сайту: |