 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Щелочноземельные металлы
6.1.7.1. Магний.Магний относится к группе макроэлементов. Физиологически активной формой этого элемента выступает катион Mg2+, занимающий в клетке второе по важности место после калия и четвертое место во всем организме, поскольку играет важную физиологическую роль в его функционировании. Половина количества магния, содержащегося в организме, приходится на мягкие ткани, вторая половина − на кости, откуда магний извлекается в случае необходимости. 1 % от общего количества магния содержится во внеклеточных жидкостях. Магний получил название главного металла жизни. Магний в качестве кофактора функционирует в более чем 300 известных ферментативных реакциях, включенных в широкий спектр метаболической активности. Выработка энергии (реакции, где принимает участие АТР, т. е. магний контролирует все энергетические процессы в организме), метаболизм глюкозы, окисление жирных кислот и активация аминокислот − во всех этих процессах требуется магний. Магний участвует в биосинтезе белка. Катион Mg2+ стабилизирует структуру ДНК и РНК и принимает участие в синтезе нуклеиновых кислот. Он отвечает за передачу нервного импульса от головного мозга к периферическим нервам и мышцам и тормозит избыточное его прохождение, т. е. защищает нашу нервную систему от стрессов и перегрузок. Магний помогает адаптироваться к холоду, служит структурным компонентом костей и зубной эмали, принимает участие в мышечном расслаблении сосудов, поддерживает клеточный иммунитет, способствует обезвреживанию токсинов в печени. Как железо для аэробных организмов, являющееся важной составной частью гемоглобина, в растительном мире эту роль играет магний, входящий в состав хлорофилла − магний-порфиринового пигмента (схема (41)), без которого не возможен фотосинтез, а значит, и существование жизни на нашей планете. Магний является антагонистом кальция. Без него кальций не усваивается. Магний модулирует и контролирует поступление кальция в клетку и выход его через мембраны саркоплазматического и эндоплазматического ретикулума (более подробно механизм функционирования кальциевых насосов и каналов, а также воздействие на них катиона магния будут рассмотрены в ч. 7). При сильно различающихся количествах поступающих в организм магния и кальция могут появиться отложения кальциевых солей в органах и тканях (отложение кальция в суставах приводит к артриту, кальциноз мозга − к потере памяти и умственных способностей). Чтобы избежать всего этого, лучше соблюдать сбалансированное поступление магния и кальция, которое должно составлять 1:2. Усвоение магния уменьшается: 1) при высоком содержании в рационе жира, поскольку жирные кислоты и магний образуют мылоподобные соли, которые не могут всасываться в желудочно-кишеч- ном тракте; 2) при достаточном содержании в пище железа; 3) при дополнительном приеме витамина D без дополнительного магния; хотя холекальциферол (витамин D3) и стимулирует до некоторой степени усвоение магния в кишечнике, стимулирующий эффект более сильно сказывается на кальции; 4) при дефиците витамина Е; 5) при потреблении алкоголя, калия и кофеина, которые увеличивают потерю магния через почки.
К сожалению, 80−90 % людей страдают от дефицита магния, что может проявляться в виде бессонницы, хронической усталости, остеопороза, артрита, мигрени, мышечных судорог и спазмов, сердечной аритмии, диабета, астмы и прочих симптомов и заболеваний. Неорганические соли магния (хлорид, сульфат), как правило, плохо усваиваются организмом через желудочно-кишечный тракт, действуя как слабительные, но прекрасно впитываются через кожные покровы, поэтому прием ванны с магниевыми солями может решить проблему дефицита этого иона в организме. Наиболее усваиваемым магниесодержащим продуктом является цитрат магния. 6.1.7.2. Кальций.Соединения другого щелочноземельного элемента кальция находятся практически во всех животных и растительных тканях. Кальций − самый распространенный макроэлемент в организме человека. В живых клетках человека и животных 1,4−2 % Са (по массовой доле); в теле человека массой 70 кг содержится около 1,7 кг кальция. Основная роль кальция состоит в организации целостной скелетной системы, в которой и находится 99 % всего кальция организма в виде гидроксиапатита Ca5(PO4)3OH, или, в другой записи, 3Ca3(PO4)2·Са(OH)2. Из карбоната кальция CaCO3 состоят раковины и панцири многих беспозвоночных, яичная скорлупа и др. Гигантский резервуар кальция, содержащийся в скелетной системе, находится в состоянии динамического равновесия с кальцием в кровеносной системе и служит в качестве буфера для поддержания стабильного уровня его циркуляции. Оставшийся 1 %, присутствующий в трех формах: в комплексе с органическими и неорганическими кислотами (лимонной, фосфорной и т. д.), в связанной с белками форме, в ионизированном виде − играет важнейшую роль в свертывании крови, генерации и передаче нервных импульсов, сокращении мышечных волокон, активации определенных ферментативных систем и выделении некоторых гормонов. Сам по себе скелет является не постоянным местом депонирования кальция, но динамическим, где образуются новые кальциевые кристаллы, а старые разрушаются. Скорость этого разрушения и построения значительно варьирует в зависимости от возраста. Пик костной массы может не быть достигнут вплоть до 25 лет. К 40−50 годам разрушение костей может превысить построение; при этом общая костная масса значительно уменьшается. Увеличение потери костной массы начинается раньше и проходит с резкими последствиями чаще у женщин, нежели у мужчин, у белых, нежели у черных, чаще у маленьких людей, нежели у высоких. Риск медицинских последствий потери костной массы, называемойостеопорозом, наибольший у маленьких белых женщин. При этом склонность к остеопорозу передается по наследству. Эта предрасположенность ответственна за преобладание переломов шейки бедра из-за ослабления кости при потере кальция в этой подгруппе женщин. Всасывание кальция происходит как в толстом, так и тонком кишечнике и облегчается кислой средой, витаминами D и С, ионами железа, лактозой, ненасыщенными жирными кислотами. Немаловажна роль магния в кальциевом обмене, при его недостатке кальций «вымывается» из костей и осаждается в почках (почечные камни) и мышцах. Усвоению кальция препятствуют аспирин, щавелевая кислота, производные эстрогена. Соединяясь с щавелевой кислотой, кальций дает не растворимые в воде соединения, которые являются компонентами камней в почках. Почему организмы выбрали Са2+ в качестве универсального регулятора? Считается, что первоначально клетка пыталась избавиться от ионов кальция из-за образования плохо растворимых солей с фосфатами, которых достаточно много в ней из-за использования для создания и накопления богатых энергией веществ (NTP). Чтобы избежать коллапса в клетке в результате выпадения в осадок фосфатов кальция, клетками были созданы специальные транспортные системы, удаляющие Са2+ из цитоплазмы, в связи с чем концентрация этого иона в клетке достаточно низкая (менее 10-7 М), а любое повышение концентрации Са2+ в цитоплазме клетками будет восприниматься как определенный сигнал к действию. Тушение кальциевого сигнала обеспечивают системы быстрого выведения кальция из цитоплазмы клетки. Эти системы встроены в мембраны. В наружной плазматической мембране клеток обнаружена Са2+-АТРаза (кальциевый насос), которая за счет энергии гидролиза АТР выкачивает ионы кальция из клетки во внешнюю среду против градиента концентрации, и Na+/Ca2+-обменник, заменяющий при определенных условиях внутриклеточный ион кальция на внеклеточный ион Na+ (рис. 6.13). В мембраны эндоплазматического ретикулума также встроена Са2+-АТРаза, удаляющая ион кальция из цитоплазмы в специальные цистерны ретикулума, где он депонируется до востребования. В митохондриях есть транспортная система, перемещающая ион кальция из цитоплазмы внутрь матрикса митохондрий. При взаимодействии определенных гормонов со своими рецепторами в клеточной мембране может происходить открытие специальных ионных каналов, по которым внеклеточный кальций поступает внутрь клетки. Открытие каналов эндо/саркоплазматического ретикулума происходит под действием вторичных посредников фосфоинозитидов. Строение и механизмы действия ионных каналов, Na+/Ca2+-обменников и Са2+-АТРазы (кальциевого насоса) будут подробно рассмотрены в ч. 7.
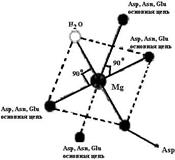
Рис. 6.13. Схема поступления иона кальция в клетку с помощью кальциевых ионных каналов в клеточной мембране или Na+/Ca2+-обменников в мембранах сарко/эндоплазматического ретикулума и митохондрий. Уменьшение концентрации ионов кальция после проведения сигнала в клетку происходит под действием Са2+-АТРазы (кальциевого насоса) После поступления иона кальция в клетку он связывается с определенными белками. Эти белки, изменив конформацию, способны влиять на многочисленные и разнообразные процессы: транспорт кальция, регуляцию клеточного цикла и активности определенных ферментов, состояние цитоскелета. Так, кальмодулин, один из наиболее распространенных регуляторных Са2+-связывающих белков, может связать и оказать регуляторное воздействие на более чем 350 разных белков. Часто он является одной из субъединиц сложных белков и участвует в регуляции активности различных киназ, синтетаз и других ферментов. Кальмодулин, связанный с ионом кальция, оказывает также регуляторное воздействие на функционирование структурных элементов клетки: актин-миозиновый комплекс, микрофибриллы, ответственные за клеточную подвижность, изменение формы клетки, митоз, эндоцитоз и т. д. (см. ч. 2). Участие иона кальция в процессе свертывания крови подробно рассмотрено в ч. 1. В ответ на стимул происходит мобилизация клеточных механизмов для удаления кальция, после чего клетка переходит в состояние покоя, в результате повышение концентрации иона кальция является кратковременным. Са2+-связывающие белки должны иметь большое сродство к этому иону, чтобы: 1) связывать его уже при малых концентрациях; 2) различать похожие ионы кальция и магния, концентрация которого в клетке достаточно высока (10-3−10-2 М). Ион кальция сильно гидратирован и удерживает вокруг себя 6−8 молекул воды. Одномоментное замещение такого количества воды невозможно, поэтому структура, связывающая ион кальция, должна быть достаточно гибкой, чтобы взаимодействовать как с полностью гидратированным ионом, так и с ионом, частично потерявшим молекулы воды. Гибкость белкового окружения нужна также и для экранирования иона кальция от воды. Гибкость обеспечивается за счет того, что большинство Са2+-связывающих белков (тропонин С, миозин, кальмодулин, кальпаин, парвальбумин, кальбиндин D и др.) содержат пространственную структуру, состоящую из мотива спираль-петля-спираль. Петля состоит из 11−14 аминокислотных остатков, α-спиральные участки по бокам − из 12−14 аминокислотных остатков, при этом они располагаются почти перпендикулярно друг другу. Впервые эта структура была обнаружена в парвальбумине − белке из мышц рыб − и получила название EF-hand. Са2+-связывающие центры сравнивают с правой рукой (hand): отставленные большой и указательный пальцы соответствуют двум α-спиральным участкам мотива, остальные сложенные пальцы изображают Са2+-связываю- щую петлю (рис. 6.14). В структуре парвальбумина на рентгенограммах четко прослеживалось расположение двух α-спиральных участков, обозначенных Е и F. В петле ион кальция координируется 6−8 кислородсодержащими лигандами: карбоксильными группами аспартата или глутамата, карбонильными группами аспарагина или глутамина, спиртовыми группами серина или треонина, а также карбонильным атомом кислорода пептидной связи (−СО−NH−). Эти лиганды располагаются в 12-членной Са2+-связывающей петле в положениях 1, 3, 5, 7, 9 и 12 (схема (42)). . Рис. 6.14. EF-hand-белки содержат мотив спираль-петля-спираль. Петля, состоящая из 12−14 аминокислотных остатков, связывает ион Са2+. Название происходит от Е- и F-спиралей парвальбумина, в структуре которого впервые она была обнаружена, а расположение этих спиралей в белке было аналогично расположению большого и указательного пальцев в руке, отсюда слово «hand» (на рисунке слева). Минимальной структурной и функциональной единицей в EF-hand-белках является димер EF-hand с линкером разной длины (справа) (согласно [13]) Боковые радикалы аминокислотных остатков повернуты внутрь петли и принимают непосредственное участие в связывании иона кальция. Пространственно полипептидная петля образует почти правильный октаэдр, в вершинах X, Y, Z, -X, -Y, -Z которого располагаются 1, 3, 5, 7, 9 и 12 аминокислотные остатки петли соответственно. Кальций оказывается в центре октаэдра и удерживается в правильном положении взаимодействием с кислородными атомами лигандов, расположенных в вершинах октаэдра (схема (43)). В положениях 8 и 10 обычно встречаются гидрофобные аминокислотные остатки, экранирующие расположенный в глубине октаэдра ион кальция от молекул воды. Остатки глицина, занимающие часто положения 4 и 6, придают спирали необходимую гибкость, особенно на первых стадиях дегидратации иона кальция. Таким образом, каждый из 12 аминокислотных остатков, входящих в петлю,
Классическая EF-hand петля (42)
или участвует в связывании иона кальция, или обеспечивает стабильность структуры полипептидной цепи. Поэтому, несмотря на многообразие, Са2+-связывающие петли Са2+-связывающих белков семейства EF-hand очень похожи между собой. В состав петли входит много отрицательно заряженных аминокислотных остатков, которые в отсутствие иона кальция отталкиваются, и петля имеет рыхлый вид, в присутствии кальция петля принимает более компактную форму.
Ион кальция подобен иону магния, но отличается от него изменяющимся в зависимости от обстоятельств координационным числом (схема (42)). Ион магния меньше по размерам (0,65 Ао), чем ион кальция (0,99 Ао), для его удержания в петле необходимо большее сближение отрицательно заряженных групп катионсвязывающей петли, что часто невозможно из-за электростатического отталкивания. Поэтому ион магния связывается с Са2+-связывающими белками с малым сродством. Малые изменения в структуре катионсвязывающей петли при связывании Са2+ приводят к существенным изменениям в структуре всего белка. Это явление и лежит в основе способности Са2+-связывающих белков регулировать разные процессы, происходящие в клетке. Одиночные Са2+-связывающие центры не обнаружены. Са2+-свя- зывающие участки образуют своеобразные пары. Минимальной структурной и функциональной единицей в Са2+-связывающих белках выступает димер EF-hand с линкером разной длины. Существуют белки с количеством EF-hand-доменов от двух до шести. Наиболее известное семейство Са2+-связывающих белков − кальмодулин-подобные белки, содержащие тандем EF-hand-доменов и способные связать четыре иона кальция (рис. 6.15). Самый простой белок, содержащий два Са2+-связывающих центра, низкомолекулярный белок кишечника, − кальбиндин − участвует в сорбции кальция в тонком кишечнике и транспорте его в клетки и активируется витамином D. Более сложно устроены белки семейства S100. Для их активации необходима димеризация, хотя каждый мономер несет два Са2+-связывающих центра. Распространение и функции их разнообразны: регуляция активности многих ферментов, регуляция сборки и разборки элементов цитоскелета, участие в процессах экзо- и эндоцитоза и т. д.
Сайты связывания кальция в различных EF-hand-доменах имеют к нему разное сродство. Так, в кальмодулин-подобных белках С-концевой домен, называемый каноническим, обладает высоким сродством к иону кальция и насыщен им даже при низкой концентрации кальция в клетке (менее 10-7 М), N-концевой домен связывает ионы кальция только при повышении их концентрации в клетке (до 10-6−10-5 М). При связывании кальция спирали В и С тропонина С или любого другого представителя семейства кальмодулина становятся перпендикулярными центральной α-спирали. Опущенные вниз и идущие параллельно длинной центральной спирали белка спирали В и С означают, что белок свободен от ионов кальция. Поднятые вверх и ориентированные перпендикулярно длинной оси белка спирали В и С говорят о том, что Са2+-связывающий белок насыщен ионами кальция и что структура перешла из закрытой конформации в открытую (рис. 6.16). Насыщение кальцием регуляторных центров свидетельствует о поступлении в клетку сигнала, на который она должна реагировать.
Рис. 6.16. Структура N-концевого домена мышечного тропонина С в отсутствие (слева − в закрытой конформации) и при связывании иона Са2+ (справа − в открытой конформации) (согласно [13]) В структуре белков-мишеней кальмодулина есть так называемые амфифильные α-спирали, одна сторона которых положительно заряжена из-за скопления основных аминокислотных остатков: лизина, аргинина − и охотно взаимодействует с водой; вторая половина, несущая гидрофобные аминокислотные остатки, старается спрятаться от воды и взаимодействует также с гидрофобными остатками. Изменив свою конформацию при связывании ионов кальция, кальмодулин открывает гидрофобные поверхности в области центральной α-спирали, ранее экранированные спиралями В и С. Эти области будут стремиться взаимодействовать с гидрофобной поверхностью амфифильной спирали белка-мишени. Особенно прочный контакт возникает, если гидрофобные участки центральной спирали кальмодулина изогнутся и обнимут амфифильную спираль белка-мишени (рис. 6.17). Конформация белка-мишени меняется, и он определенным способом активируется (в ч. 2 это было рассмотрено на примере активации кальмодулином киназы легких цепей миозина (рис. 6.18)).
Рис. 6.17. Схема строения кальмодулина, насыщенного кальцием (а), и его комплекса с амфифильной спиралью белка-мишени (б). Полусферы изображают N- и С-концевые участки кальмодулина, соединенные жесткой и прямой α-спиралью. При взаимодействии со спиральным участком белка-мишени, изображенного на рисунке в виде цилиндра, центральная спираль кальмодулина «плавится», изгибается и ее гидрофобные области охватывают амфифильную область белка-мишени (согласно [3]) Содержание кальция в крови из-за большого количества связанных с ним процессов регулируется с помощью гормонов: паратиреоидного, кальцитриола и кальцитонина. Контролируемый ими сложный механизм гомеостаза кальция обеспечивает его экстракцию из источников питания и предотвращение резких колебаний концентрации иона кальция во внеклеточной жидкости. При резком падении концентрации ионизированного кальция в крови ниже определенного значения увеличивается секреция паратиреоидного гормона, стимулирующего высвобождение кальция и фосфата из костей. Кальцитриол усиливает всасывание кальция и фосфата из кишечника. Увеличение концентрации кальция по типу обратной связи вызывает торможение секреции паратиреоидного гормона и образование кальцитриола. Увеличение концентрации внеклеточного кальция приводит к возрастанию секреции клетками щитовидной железы кальцитонина, тормозящего высвобождение кальция из костей.
Рис. 6.18. Модель регуляции кальмодулином некоторых ферментов. В состоянии покоя кальмодулинзависимый фермент неактивен, так как его активный центр блокирован псевдосубстратным участком регуляторного домена. Кальмодулин (СаМ), насыщенный ионами кальция, взаимодействует с регуляторным доменом, освобождает активный центр фермента для протекания каталитической реакции (согласно [3]) При правильном питании дефицита кальция, как правило, не возникает. Продолжительное отсутствие в рационе может вызвать судороги, боль в суставах, сонливость, дефекты роста, а также запоры. Более глубокий дефицит приводит к постоянным мышечным судорогам и остеопорозу. Злоупотребление кофе и алкоголем могут также быть причинами дефицита кальция, поскольку часть его выводится с мочой. Избыточные дозы кальция и витамина D могут вызвать гиперкальцемию, после которой следует интенсивная кальцификация костей и тканей (в основном затрагивает мочевыделительную систему). Продолжительный переизбыток нарушает функционирование мышечных и нервных тканей, увеличивает свертываемость крови и уменьшает усвояемость цинка клетками костной ткани. Максимальная дневная безопасная доза составляет для взрослого от 1 500 до 1 800 миллиграммов. 6.1.8. Переходные металлы.В живых организмах обнаружены многие переходные металлы: железо, медь, марганец, кобальт, хром, цинк. Переходные металлы, т. е. элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, выделяют на основании незавершённости внутренних электронных оболочек (d-оболочек) их атомов или ионов. Цинк, кадмий и ртуть, обычно причисляемые к переходным металлам, строго говоря, таковыми не являются, поскольку их катионы имеют завершённый d-подуровень. Незавершённость внутренних электронных оболочек предопределяет наличие у переходных металлов ряда специфических свойств: способности к образованию координационных соединений, ферромагнетизма некоторых металлов, парамагнетизма многих соединений и т. д. Переходные металлы являются микроэлементами, так как содержатся в организмах в очень малых количествах, и это указывает на то, что их значение должно быть связано с катализом. Основная функция большинства переходных металлов, таких как Fe, Cu, Co, Mn, заключается в участии в ферментативных реакциях в роли кофактора. Чаще всего это окислительно-восстановительные реакции, среди которых выделяются реакции, ведущие к образованию и превращениям в организме активных форм кислорода. Но некоторые переходные металлы участвуют также в синтетазных, трансферазных, изомеразных реакциях. Переходные металлы (Zn, Mn) важны и для стабилизации структуры биополимеров. Многочисленны процессы, в которых они принимают участие и которые мы рассмотрим при обсуждении отдельных представителей данной группы. 6.1.8.1. Железо. В биологических объектах железо встречается в степенях окисления +2 (ферро), +3 (ферри), +4 (феррил). Предпочтительными биологическими лигандами для железа выступают атомы кислорода, азота, серы. Поэтому основные процессы в организме, в которых принимает участие железо, – это транспорт и депонирование кислорода, перенос электронов по дыхательной цепи, окислительно-восстановительные реакции. Белки, содержащие железо, относятся к одной из четырех групп: железосодержащие неферментативные белки (гемоглобин, миоглобин, гемоэритрин), железосерные ферменты (NADH-оксидоредуктаза, ксантиноксидаза, рибонуклеотидредуктаза), гемсодержащие ферменты (цитохромы, каталаза, пероксидаза, нитрооксидсинтаза) и ферменты, в которых железо не входит ни в гем, ни в железо-серный кластер (тирозингидроксилаза, пролиноксидаза) (схема (44)). Железо может быть для клетки одновременно полезным и вредным. Все мы хорошо знаем, что без гемоглобина, миоглобина, цитохромов и железосерных белков невозможно существование аэробных организмов. С другой стороны, ион Fe2+ в свободном состоянии опасен для клетки, так как катализирует образование активных форм кислорода, повреждающих структурные элементы клетки и нарушающих механизмы ее функционирования (см. п. 6.1.2 и схемы (3), (24), (25)). В организм млекопитающих, в том числе человека, железо поступает при помощи различных белков-переносчиков. Эти белки и способы хранения железа в клетке подробно рассмотрены в ч. 1 гл. 1.3. Здесь мы кратко напомним эти вопросы. Железо поступает в организм в виде комплексов гемового железа, усвояемость которого высока, и негемового железа, усвояемость которого низка (всего несколько процентов от поступившего). Для переноса через апикальную мембрану клетки ион Fe3+ восстанавливается дуоденальным цитохромом B (DCYTB), ферментом, локализованным в мембране энтероцитов, и переносится транспортером дивалентных металлов 1 (divalent metal transporter 1, DMT1). Последний может транспортировать через апикальную мембрану также ионы цинка, марганца, кобальта, меди, кадмия, никеля. Для переноса через базолатеральную мембрану энтероцита с помощью переносчика IREG 1 (iron-regulated protein 1) или ферропротеина 1 ион Fe2+
Рис. 6.19. Перенос иона железа через мембраны энтероцита в кровь снова окисляется белком гефестином, феррооксидазой, структурно и функционально подобной церулоплазмину (медьсодержащей феррооксидазе, обнаруженной во многих тканях организма и участвующей в реакциях окисления-восстановления иона железа, связанного с ферритином). Поступив в кровь, Fe3+ взаимодействует с трансферрином (рис. 6.19) и переносится к клеткам по всему организму. Клетки, на мембранах которых есть рецепторы к трансферрину, захватывают комплекс железо-трансферрин, и железо поступает внутрь клетки путем эндоцитоза. Поступившее железо может использоваться для синтеза железосодержащих белков или депонироваться в ферритине. У аэробных организмов плохо развиты системы вывода железа, поэтому в случае его избытка и невозможности депонирования в ферритине железо откладывается непосредственно в разных органах и тканях, нарушая их функционирование. Из-за токсичности свободного железа содержание его в клетке точно регулируется на стадии трансляции мРНК ферритина и рецепторов трансферрина, содержащих в нетранслируемых областях специфические шпилечные структуры, так называемые железочувствительные элементы (IRE, iron responsive element). Связывание с этими элементами регуляторных белков регулирует количество железа в клетке: повышение потребности клеток в железе при их быстром росте или синтезе гемоглобина ведет к индукции биосинтеза рецепторов трансферрина, и, напротив, при повышении запасов железа в клетке увеличивается синтез ферритина (см. ч. 1 гл. 1.3). Недостаток железа в организме является причиной возникновения железодефицитной анемии, развивающейся в результате длительного отрицательного баланса железа, когда снижается синтез гемоглобина. 6.1.8.2. Медь.Медь является важным микроэлементом для всех форм жизни. Этот переходный металл участвует в различных биологических процессах: в эмбриональном развитии, в транспорте кислорода у некоторых организмов (гемоцианин), в митохондриальной дыхательной цепи (цитохром с оксидаза), в метаболизме железа (церулоплазмин), детоксикации активных форм кислорода (супероксиддисмутаза), в биосинтезе нейротрансмиттеров (дофамингидроксилаза) и т. д. В клетке медь встречается в двух степенях окисления: Cu2+ (окисленная форма) и Cu1+ (восстановленная форма). Таким образом, этот элемент участвует как кофактор в окислительно-восстановительных реакциях. Попав в кровь после переноса через клеточную мембрану энтероцита (при этом ион Cu2+ восстанавливается в Cu1+ железосодержащей редуктазой), медь транспортируется в комплексе с альбумином, транскупреином, небольшими пептидами и даже отдельными аминокислотами, такими как гистидин, в печень, орган, где она депонируется и подвергается различным превращениям. Из печени к клеткам организма медь доставляется альбумином или многофункциональным белком церулоплазмином. Депонирование меди осуществляет белок металлотионеин, треть которого представлено двадцатью остатками цистеина, способного связать до семи ионов Cu1+. Поскольку медь – переходный металл и легко вступает в окислительно-восстановительные реакции с образованием гидроксильного радикала, организм пытается защитить себя от его токсического действия: в организме медь редко встречается в свободном виде, в основном в виде комплексов купробелков, купротранспортеров или купрошаперонов. Например, для активации таких медьсодержащих ферментов, как цитохром с оксидаза или Cu, Zn-супероксиддисмута-за (СОД), к месту их синтеза металл переносят купрошапероны (CCS, Аtox1, Cox17, НАН1). В нейронах и астроцитах медь переносится специфическими АТРазами. Перенос металла через клеточные мембраны у человека осуществляет купротранспортер hCtr1. На рис. 6.20 изображено поступление меди в клетку и использование этого иона на ее нужды.
Рис. 6.20. Поступление иона меди в клетку с помощью транспортера hCtr1 и использование для синтеза цитохром с оксидазы с помощью купрошаперона Cox17, Cu, Zn-супероксиддисмутазы (СОД) с помощъю купрошаперона CCS; купрошаперон НАН1/Atox1 транспортирует медь в аппарат Гольджи для включения в секретируемые белки. WND и MNK – АТРазы, осуществляющие транспорт иона меди внутри клетки и через клеточную мембрану. К другим клеткам ион меди может доставлять и церулоплазмин. Депонирование меди в клетке осуществляет металлотионеин (согласно [26]) На схеме (45) представлены реакции, которые катализируют медьсодержащие ферменты. В белках медь встречается в комплексах нескольких видов (схемы (46) и (47)). 1. Моноядерный комплекс, имеющий или планарную конфигурацию (схема (47), а), или форму неправильного тетраэдра (схе- ма (47), б), в вершинах которого располагаются остатки цистеинов, гистидинов и метионина, а медь в центре тетраэдра (такой центр связывания металла получил название места связывания иона меди I типа) встречается часто в так называемых синих белках (купредоксинах, азурине, пластоцианине), поскольку эти комплексы ярко-си- Схема 45
него цвета, обусловленного переносом электрона от тиолатного остатка цистеина к иону Cu2+ (Cys− → Cu2+).
Эти центры приспособлены к переносу одного электрона. На рис. 6.21 представлена пространственная структура азурина и место связывания иона меди I типа в этом белке.
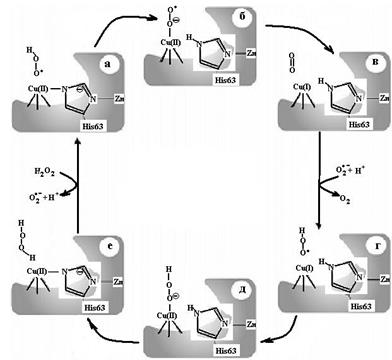
2. Место связывания иона меди II типа (схема (47), в), в котором в координационной сфере, содержащей 3−4 лиганда, присутствуют остатки гистидина (несколько), глутамата, глутамина, метионина и тирозина, остатков цистеина нет, имеет слегка искаженную плоскостную конфигурацию. Чаще всего это мононуклеарные сайты. Одно из положений координационной сферы иона меди занимает непосредственно субстрат: если это молекула кислорода, то центр связывания иона меди II типа может функционировать как оксидаза, восстанавливая кислород или с образованием воды, или пероксида водорода (аминооксидаза), или монооксигеназа (дофамингидроксилаза), включая один атом кислорода в продукт реакции, второй в молекулу воды, или диоксигеназа, когда оба атома кислорода входят в состав продукта (цитохром с оксидаза). Этот центр способен обезвреживать супероксидный и нитритный анионы (рис. 6.22 и схема (46)).
Рис. 6.21. Пространственная структура азурина (а) и место связывания иона меди I типа в этом белке (б) (согласно [22]) 3. Место связывания иона меди III типа, являясь динуклеарным, состоит из двух ионов меди, мостиком между которыми выступает или молекула кислорода, или гидроксильный анион. Динуклеарный кластер ионов меди III типа обнаружен в гемоцианинах (схема (48)), служащих переносчиками кислорода у беспозвоночных, в тирозиназе, участвующей в реакции активации молекулы кислорода и гидроксилировании.
Встречаются более сложно устроенные белки, в которых присутствуют ионы меди разных типов. Например, в мультимедных оксидазах (аскорбатоксидаза) центр связывания иона меди III типа и два иона меди II типа образуют каталитический тринуклеарный кластер. Церулоплазмин, медьзависимая феррооксидаза, участвующая в
Рис. 6.22. Механизм действия Cu, Zn-супероксиддисмутазы, включающий протонирование супероксидного аниона до взаимодействия с центром связывания иона меди II типа и окислительную координацию во время стадии окисления (согласно [21])
метаболизме железа (рис. 6.23), содержит 6 ионов меди всех трех типов: три места связывания иона меди I типа, одно – II типа вблизи от двух ионов меди III типа; последние три образуют тринуклеарный кластер, связывающий молекулу кислорода во время каталитического акта (схема (45)). Церулоплазмин окисляет ион Fe2+, высвобождаемый из ферритина, который играет роль центра депонирования железа в организме позвоночных, делая при этом возможным его взаимодействие с трансферрином. Трансферрин переносит этот ион к месту востребования. Таким образом, дефицит церулоплазмина может приводить к дефициту железа в организме. Кроме участия в метаболизме железа, церулоплазмин оказался белком со многими функциями. Так, концентрация белка увеличивается при воспалительных процессах. Считается, что это связано с участием церулоплазмина в дезактивации активных форм кислорода.
Рис. 6.23. Роль церулоплазмина как феррооксидазы (RH2 – аскорбат; R – дегидроаскорбат; Нb – гемоглобин) (согласно [17]) В настоящее время подробно изучены два патологических процесса, связанных с метаболизмом меди: синдром Менке (дефицит поступления меди в клетки) и синдром Вильсона (избыточный транспорт и токсикоз). Оба заболевания связаны с мутациями в генах, кодирующих белки-транспортеры меди в мембранах клеток или органелл. При синдроме Менке наблюдается неврологическая дегенерация, слабая регуляция температурного режима организма и смертность во младенческом возрасте. При синдроме Вильсона медь не способна выделяться с желчью, встраиваться в белки, такие как церулоплазмин; она накапливается в печени, приводя к циррозу. 6.1.8.3. Марганец. Этот переходный металл также является важным микроэлементом для живых организмов. Марганец поступает в организм в виде соединений Мn2+ и Mn4+, имеет существенное значение в развитии скелета, энергетическом метаболизме, функционировании нервной и иммунологической систем, активации некоторых ферментов и защите организма от действия активных форм кислорода. В мозге Мn2+ выступает в качестве кофактора в реакциях биосинтеза и метаболизма нейротрансмиттеров. Три основные метаболические функции иона марганца заключаются в: 1) активации ключевых ферментов глюконеогенеза – пируваткарбоксилазы и изоцитратдегидрогеназы; 2) защите митохондриальных мембран с помощью Mn-супероксиддисмутазы; 3) активации гликозилтрансферазы при синтезе полисахаридов. Дефицит марганца приводит к изменениям в метаболизме углеводов, в том числе глюкозы, и липидов, к нарушениям синтеза и функционирования инсулина. Ионы марганца участвуют не только в реакции инактивации супероксидного аниона, катализируемой Mn-супероксиддисмутазой, но и в разложении пероксида водорода под действием негемовой каталазы, в которой место кофактора, переносящего электроны, занимает динуклеарный Mn-содержащий активный центр. Этот центр функционирует в двух состояниях: восстановленном [Mn2+−Mn2+] и окисленном [Mn3+−Mn3+]. Похожий центр обнаружен также и в аргиназе, катализирующей гидролиз аргинина с образованием орнитина в цикле мочевины (рис. 6.24).
Рис. 6.24. Динуклеарные Mn-содержащие активные центры каталазы Lactobacillus plantarum (а) и аргиназы из печени крысы (б) (согласно [7, 11]) Ионы марганца, как известно, принимают участие в синтезе молекулы кислорода в растительных клетках. Эту реакцию осуществляет водоокисляющий комплекс фотосистемы II, содержащий четыре иона марганца и один ион кальция. На рис. 6.25 представлено два возможных механизма образования молекулы кислорода: а) депротонирование кислородного атома одной молекулы воды под
Рис. 6.25. Предполагаемые механизмы образования молекулы кислорода при функционировании водоокисляющего комплекса фотосистемы II (согласно [9]) действием сильного окислителя – Mn4-кластера и образование сильно электрофильного атома кислорода, подвергающегося нуклеофильной атаке атомом кислорода второй молекулы воды, связанной в координационной сфере иона кальция; б) альтернативный механизм предполагает после депротонирования молекулы воды образование из кислородного атома на окисляющем Mn4-кластере радикала, атакующего или кислород в составе второй молекулы воды, или кислород, связывающий ионы кальция и марганца, с образованием молекулы кислорода. Ионы Mn2+ присутствуют в качестве кофактора в реакции окислительного декарбоксилирования изоцитрата, катализируемой изоцитратдегидрогеназой. Образуя координационные связи с кислородными атомами концевой карбоксильной и соседней с ней гидроксильной групп, Mn2+ облегчает отрыв атомов водорода (схема (49)).
Ионы Mn2+ способны замещать ионы Mg2+ в ферментативных реакциях. Но из-за разных размеров этих ионов, например в фосфотрансферазных реакциях (ион Mg2+ координирует α- и β-фосфатные остатки dNTP (NTP), а Mn2+ способен взаимодействовать со всеми тремя остатками), наблюдается много ошибок в считывании матриц ДНК или РНК ДНК- и РНК-полимеразами. Марганец является токсичным соединением для большинства организмов. Так, попадая в митохондрии, он нарушает функционирование дыхательной цепи, ингибируя окислительное фосфорилирование, что приводит к недостаточному энергетическому потенциалу клеток организма. В нейронах и астроцитах марганец отрицательно воздействует на выделение многих нейротрансмиттеров: глутамина, ГАМК и т. д. Отложение марганца в нервной ткани головного мозга является одним из факторов развития болезни Паркинсона. При болезни Альцгеймера у пациентов также определяется повышенное содержание марганца в головном мозге. 6.1.8.4. Кобальт.Важность этого переходного металла в жизнедеятельности организмов определяется тем, что он является составной частью витамина В12, кофермента кобаламинзависимых ферментов. Витамин В12 содержит корриновое кольцо, состоящее из четырёх пиррольных гетероциклов, соединённых тремя метиленовыми мостиками и одной углерод-углеродной связью. От порфирина, входящего в состав гема, коррин отличает отсутствие метиленового мостика между парой пиррольных колец (схема (50)).
У коррина в сравнении с порфирином, во-первых, нарушена система сопряженных двойных связей, во-вторых, структура не такая плоская, как структура порфирина. В структуре витамина В12 ион кобальта Со3+ располагается в центре корринового ядра, образуя координационные связи с атомами азота пиррольных гетероциклов, с находящимися по разные стороны плоскости корринового кольца диметилбензимидазолом и цианид-ионом (гидрокси-анионом, метильной группой или 5’-дезоксиаденозильным остатком) (схема (51)). Особенность витамина В12 заключается в том, что он содержит σ-связь между кобальтом и атомом углерода, которая не встречается в других природных металлоорганических соединениях. Распад этой связи приводит к образованию радикала, являющегося важной составной частью механизма действия кобаламинзависимых ферментов.
Всасывание витамина В12 происходит в желудке в комплексе с гликопротеином – внутренним фактором Касла, который секретируется обкладочными клетками слизистой оболочки желудка. После поступления в клетки слизистой (энтероциты) в дистальном отделе повздошной кишки комплекс разрушается, фактор Касла или подвергается протеолизу, или секретируется в просвет кишечника, а В12 связывается с транскобаламином. Нарушение всасывания витамина В12 наблюдаются при пернициозной анемии, когда имеет место генетический дефект синтеза фактора Касла, при резекции желудка, заражении гельминтами. Транспорт витамина В12 в крови осуществляют особые белки – транскобаламины. Они же выполняют функцию его депонирования. В печени происходит превращение витамина В12 в гидроксикобаламин, далее в митохондриях Со3+ в составе витамина восстанавливается в Со+, после чего дезоксиаденозилтрансфераза замещает ОН-ион на остаток дезоксиаденозила, превращая витамин В12 в кофермент 5’-аденозилкобаламин. Под действием S-аденозилметио-нин-В12-метилтрансферазы образуется другой кофермент – метилкобаламин. Оба кофермента представляют собой биологически активные формы витамина В12 в организме человека. Они входят в состав ферментов, обнаруженных у многих животных, – метилмалонилСоА-мутазы (ММСМ), катализирующей превращение метималонилСоА в сукцинилСоА, и тетрагидроптероилглутаматметил-трансферазы (ТГМТ), участвующей в синтезе метионина из гомоцистеина.
Рис. 6.26. Механизм реакция изомеризации метилмалонилСоА в сукцинилСоА под действием комплекса метилмалонилСоА-мутазы (ММСМ) и 5’-аденозилкобаламина: а – отрыв атома водорода от метильной группы 5’-аденозильным радикалом, образовавшимся при распаде связи Со-С в 5’-аденозилкобаламине; b – перенос СОSСоА-группы на метиленовый радикал с образованием радикала при соседнем атоме углерода; с – перенос атома водорода от аденозила на атом углерода, содержащий неспаренный электрон (согласно [19, 28]) Реакции, катализируемые кобаламинзависимыми ферментами: реакции трансметилирования и внутримолекулярного переноса протона в реакциях изомеризации – основаны на расщеплении и образовании связи Со−С. Так, перегруппировка метилмалонилСоА в сукцинилСоА (рис. 6.26), катализируемая ММСМ, включает в себя отрыв атома водорода от метильной группы метилмалонилСоА на первой стадии реакции под действием образовавшегося при распаде связи Со−С 5’-дезоксиаденозильного радикала (схема (52)), на второй стадии внутримолекулярный перенос СОSСоА-группы на метиленовый радикал. Реакция заканчивается обратным переносом атома водорода, но не на прежнее место, а к соседнему углеродному атому.
Таким образом, ММСМ катализирует реакцию полимеризации и внутримолекулярный перенос протона, а ТГМТ – перенос метильной группы от N5-метилтетрагидрофолата через образование метилкобаламина на акцептор, в данном случае эту роль выполняет тиоловая группа гомоцистеина, превращаясь в метионин (рис. 6.27). Реакция, катализируемая ТГМТ, сопровождается гетеролитическим распадом/образованием связи Со−СН3 и обращением конфигурации продуктов реакции согласно механизму SN2. При нарушениях процесса метилирования гомоцистеина страдает метаболизм фолиевой кислоты и нарушается синтез ДНК, что увеличивает риск тромбозов. Дефицит метионина вызывает также дефицит S-аденозилметионина и нарушение синтеза холина и содержащих его фосфолипидов – лецитина и сфингомиелина, что приводит к поражению нервной системы. В случае дефицита аденозилкобаламина происходит накопление метилмалонилСоА и его предшественника – пропионилСоА. Это приводит к тому, что в клетках нервной системы синтезируются и встраиваются в фосфолипиды жирные кислоты с нечетным количеством атомов углерода, что не является обычным, и это также приводит к неврологическим нарушениям.
Рис. 6.27. Механизм реакции переноса метильной группы, катализируемой тетрагидроптероилглутамат-метилтрансферазой (ТГМТ), от N5-метил-тетрагидрофолата к кобаламину с образованием метилкобаламина и далее после распада связи Со−СН3 к акцепторной тиоловой группе гомоцистеина (согласно [19]) Человек и животные получают витамин В12 в результате потребления продуктов питания животного происхождения и синтеза его микрофлорой пищеварительного тракта. В растительных продуктах питания В12 практически не содержится. 6.1.8.5. Хром.Этот переходный металл, необходимый для нормального развития и функционирования человеческого организма, в биохимических процессах участвует только в степени окисления 3+. Основные его функции в клетке касаются регуляции обмена углеводов и холестерина, уровня глюкозы в крови, активации некоторых ферментов. Хром входит в состав низкомолекулярного (1 500 Da) комплекса – фактора толерантности к глюкозе (GTF). Этот комплекс облегчает взаимодействие инсулина с его клеточными рецепторами, увеличивая их число и скорость фосфорилирования (рис. 6.28), и уменьшает потребность организма в инсулине, усиливая при этом его действие во всех процессах, где он участвует.
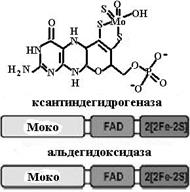
Рис. 6.28. Влияние хрома на клеточный рецептор инсулина путем увеличения количества рецепторов и скорости их аутофосфорилирования При дефиците хрома в организме могут возникнуть диабетоподобное состояние, атеросклероз и нарушение нервной деятельности. Хром в своих высших степенях окисления токсичен, особенно соединения шестивалентного хрома, вызывающие аллергию, мутации и канцерогенез. 6.1.8.6. Молибден.Молибден поступает в организм в виде иона МоО42-. Этот переходный металл принимает участие в окислительно-восстановительных реакциях, изменяя свою степень окисления от +4 до +6. Значение молибдена для клетки определяется ферментными системами, в которых он принимает участие как кофактор − нитратредуктаза, ксантин- (К.Ф. 1.1.1.204), альдегид- и сульфитоксидазы (К.Ф. 1.3.8.1). В п. 6.1.3.1 мы описали процесс азотфиксации, в котором ключевую роль играет нитрогеназа, содержащая Mo-Fe-белковый кофактор. Перечисленные выше ферменты являются гомодимерами и имеют в своем составе уникальные молибденовые коферменты (молибдоптерины, Мосо). Кроме них, эти ферменты содержат и другие простетические группы, а именно гем (типа цитохрома b5), FAD и комплексы негемового железа [2Fe-2S] (рис. 6.29).
Рис. 6.29. Коферменты молибденсодержащих ферментов (молибдоптерины) и их схематичное строение Сульфитоксидаза и нитратредуктаза входят в одно семейство, содержащее гемовый домен, который или получает электроны от Мосо-домена (сульфитоксидаза), или передает свои электроны на Мосо-домен (нитратредуктаза). Окисляя субстрат – сульфит, сульфитоксидаза передает электроны на цитохром с, для восстановления нитрата нитратредуктаза получает восстановительные эквиваленты от NADPH. Каталитический цикл первого фермента включает окисление сульфита, сопряженное с восстановлением молибдена, с последующими стадиями переноса электрона от цитохрома b5 к цитохрому с. В отличие от сульфитоксидазы, нитратредуктаза содержит на С-конце FAD-домен, в котором NADH или NADPH передают электроны и протоны для восстановления нитрат-иона. Члены семейства ксантиноксидазы катализируют гидроксили-рование атома углерода (в альдегидах или ароматических гетероциклах), используя для внедрения в окисляемый субстрат атом кислорода воды. Эти ферменты − молибдо-флавопротеины. Ксантиноксидаза, ключевой фермент процесса деградации пуринов, катализирует превращение гипоксантина в ксантин и далее в мочевую кислоту. Электроны, высвобожденные в ходе процесса гидроксилирования, передаются через железосерные кластеры и FAD к молекулярному кислороду с образованием супероксидного аниона (ксантиноксидаза) или NAD+ (ксантиндегидрогеназа). 6.1.8.7. Цинк.Этот переходный металл обладает заполненной d-оболочкой (d10), вследствие этого он не участвует в окислительно-восстановительных реакциях, что характерно для других переходных металлов. Ион цинка, попадая в организм, транспортируется к клеткам в комплексе с белком-переносчиком металлотионеином. Поскольку с этим же белком образует комплекс и ион меди, то этим объясняется физиологический антагонизм меди и цинка. Биологическая роль этого элемента в организме разнообразна. Прежде всего цинк является составной частью большого числа ферментов, участвующих в различных метаболических процессах синтеза и распада углеводов, жиров, белков, нуклеиновых кислот. Среди цинксодержащих ферментов − белки всех шести классов: гидролазы (карбоксипептидаза, щелочная фосфатаза, аминопептидаза, фосфолипаза С, АМР-деаминаза, неорганическая пирофосфатаза), лиазы (альдолаза, карбоангидраза, густин, коллагеназа), фосфотрансферазы (РНК- и ДНК-полимеразы, обратная транскриптаза, тимидинкиназа), оксидоредуктазы (алкогольдегидрогеназа, лактатдегидрогеназа, супероксиддисмутаза), лигазы (пируваткарбоксилаза), изомеразы. Ион цинка с координационным числом четыре образует комплексы, имеющие тетраэдрическое строение. Существуют и октаэдрические комплексы цинка, когда координационное число равно шести. Цинк в большинстве своих комплексов (даже в окислительно-восстановительных реакциях) выступает в качестве сильной кислоты Льюиса, оттягивая на себя электронные пары. В качестве лигандов, взаимодействующих с этим ионом, выступают атомы азота имидазольного кольца гистидина, кислорода карбонильных групп аспарагиновой или глутаминовой кислот, серы цистеина, реже атом кислорода гидроксильной группы тирозина или карбонильных групп аспарагина или глутамина. Ион цинка в белках может играть каталитичесую или структурную роль. В первом случае он непосредственно занят в каталитическом акте, во втором − стабилизирует пространственную структуру белка аналогично дисульфидной связи или, связавшись с регуляторным сайтом, оказывает влияние на протекание ферментативной реакции. В каталитическом центре ион цинка связан с молекулой воды, которая или ионизуется с образованием гидроксильного иона, как в карбоангидразе, или поляризуется, как в карбоксипептидазе. В обоих случаях образуется нуклеофил, участвующий в каталитической реакции и атакующий карбонильный углеродный атом пептидной связи, атом углерода в углекислом газе или атом фосфора в фосфатных эфирах. Этот нуклеофил в смешанных комплексах фермент –Zn2+ − субстрат или замещается на субстрат, или имеет место увеличение координационной сферы (схема (53)). Таким образом, каталитическое место связывания цинка характеризуется открытой координационной сферой в отличие от структурного места связывания, где все места вокруг иона Zn2+ заняты аминокислотными остатками (схема (54)).
Ион Zn2+ в каталитическом месте связан обычно с тремя аминокислотными остатками, это комбинация из остатков гистидина, аспарагиновой или глутаминовой кислот, цистеина, при этом остаток гистидина встречается гораздо чаще других перечисленных остатков, а в структурном сайте связывания цинка, наоборот, преобладают остатки цистеина.
На рис. 6.30 представлены структура активного центра (а) и механизм действия (б) дрожжевой карбоксиангидразы, катализирующей образование бикарбонатного аниона из углекислого газа и воды с помощью гидроксильного иона, полученного ионизацией молекулы воды под действием иона цинка.
Рис. 6.30. Структура активного центра (а) и механизм действия (б) дрожжевой карбоксиангидразы (согласно [20]) Структура активного центра и механизм действия цинксодержащих экзопептидаз – карбоксипептидаз подробно описаны в ч. 5 п. 5.1.5.2. В составе другого цинксодержащего энзима – алкогольдегидрогеназы из дрожжей два иона цинка: один каталитический и один структурный. На рис. 6.31 приведены схемы устройства активного центра дрожжевой алкогольдегидрогеназы (а) и места связывания структурного иона цинка (б) (этот сайт высоко консервативен для алкогольдегидрогеназ всех классов, что свидетельствует о его особой роли в поддержании пространственной структуры данного фермента).
Рис. 6.31. Структурная схема активного центра дрожжевой алкогольдегидрогеназы, катализирующей реакцию восстанавления уксусного альдегида в этанол (а) и места связывания структурного иона цинка (б) (согласно [8, 31]) Важную структурную роль ион цинка играет в белок-нуклеиновом и белок-белковом взаимодействиях, осуществляемых так называемыми «цинковыми пальцами». Такое название получила супервторичная структура белка, образованная приблизительно из тридцати аминокислотных остатков и ионов цинка (одного или нескольких), тетраэдрически координированных остатками гистидина, цистеина и изредка аспартата. В настоящее время известно более десятка классов структур «цинковых пальцев». Они играют различную роль в функционировании клетки, принимая участие во взаимодействии белка с нуклеиновыми кислотами (ДНК и РНК), липидами, другими белками. Часто белки содержат несколько структур «цинковых пальцев», относящихся к тому же к разным классам. Наиболее изучены «цинковые пальцы» в составе факторов транскрипции. Классический «цинковый палец» имеет структуру С2Н2, где ион цинка координирован двумя остатками цистеина и двумя гистидина, и взаимодействует с 2−4 парами гетероциклических оснований в структуре нуклеиновой кислоты (схема (55)).
На схеме (56) приведены некоторые структуры «цинковых пальцев», встречающихся в составе различных белков. Структурную роль ионы цинка играют и в инсулине: они необходимы для образования кристаллических форм (гексамеров) инсулина, в виде которых этот гормон депонируется β-клетками поджелудочной железы (схема (57)). Цинк также необходим для обоняния и нормального восприятия вкуса продуктов. Он входит в состав белка густина (от англ. gust − «острый приятный вкус»), вырабатываемого околоушной слюнной железой и играющего важную роль во вкусовой чувствительности. Густин, идентифицированный как карбоангидраза VI, специфически
связывается с мембранами вкусовых сосочков и регулирует поступление в них питательных веществ. Цинк оказывает влияние на усвоение организмом витамина А. В отсутствие достаточного количества этого металла организм не может синтезировать белок, транспортирующий витамин А через стенку кишечника и освобождающий его в кровь. Это приводит к уменьшению поступления витамина А к тканям. А дефицит витамина А препятствует усвоению цинка. Поскольку цинк тормозит высвобождение из клеточных мембран гидролитических ферментов (катепсина D, коллагеназы), контролирующих распад поврежденных тканей, он способствует заживлению ран. Активируя ферменты нуклеинового и белкового синтеза, цинк в случае дефицита вызывает задержку деления клеток и роста организма. Но это свойство цинка может обернуться и злом для организма, так как злокачественные клетки для своего роста требуют большого количества данного металла. В случае дефицита цинка наблюдаются также выпадение волос, ухудшение памяти, снижение внимания, угнетение процессов сперматогенеза и торможение развития первичных и вторичных половых признаков, токсикозы беременности. Ион цинка обладает высоким сродством к сульфгидрильным группам, которые, как известно, определяют третичную структуру и функции белка. Цинк защищает эти группы от окисления ионами железа и меди, тем самым стабилизируя пространственную структуру белка и постоянство проявления его функций. Таким образом, влияние иона цинка на метаболизм организма огромно и затрагивает разнообразные функции. 6.1.9. Галоиды. Соединения галоидов − хлора, фтора, брома и йода − широко представлены в различных живых организмах и выполняют разнообразные функции. Хлор относится к группе макроэлементов, остальные галоиды являются микроэлементами. 6.1.9.1. Хлор. Наиважнейшая функция хлора в организме − образование соляной кислоты, играющей большую роль в процессе пищеварения. Подробно этот процесс был рассмотрен нами в ч. 5 п. 5.1.1. Соляная кислота секретируется в просвет желудка обкладочными клетками, при этом ион хлора поступает из крови в обмен на ион бикарбоната, синтезируемого под действием карбоангидразы, согласно уравнению: CO2 + H2O « H2CO3 « H+ + HCO-3. (58) Соляная кислота нужна для инактивации патогенных микроорганизмов, поступающих в желудочно-кишечный тракт вместе с пищей, для денатурации пищевого белка, активации пищеварительного фермента – пепсиногена и поддержании низкого рН среды, так как желудочные пептидазы активны в кислых условиях. 6.1.9.2. Фтор. Биологическое действие этого элемента основано прежде всего на его способности замещать ион гидроксила как в минерализованной, так и в неминерализованной тканях и в активных центрах ферментов. Основой твердых тканей является основной фосфат кальция – апатит, соответствующий формуле Са10(РО4)6(ОН)2. Фторид-ион имеет много сходств с гидроксильным ионом: одинаковый заряд, близкие ионные радиусы, степень гидратации, равная двум. Все это позволяет фторид-иону встраиваться вместо гидроксил-иона в минерализованные ткани с образованием смешанной формы апатита, соответствующей структурной формуле Са10(РО4)6(ОН)2-хFx.. Обычно соотношение гидроксил-иона к фториду в апатите кости и зубной эмали составляет 40:1. Замещение может происходить как при формировании первичного кристалла апатита (тогда фторид-ион способствует формированию центров кристаллизации), так и в уже преобразованном минерале, что характерно для взрослых особей. С возрастом количество фтора в костях увеличивается. При дефиците его в организме фторид может мобилизоваться из костной ткани и поступать во внеклеточную жидкость. Фторид-ион придает кристаллам фторапатита большую упорядоченность по сравнению с обычным апатитом и снижает их растворимость при физиологических значениях рН. Проявлениями дефицита этого элемента в организме считается развитие кариеса зубной ткани и остеопороза, хотя у исследователей нет единого мнения на этот счет. Оба процесса, по-видимому, запускаются множеством факторов, а не только малой концентрацией фторид-иона. Фторид может ингибировать и активировать ферменты. Его ингибирующее действие на металлоферменты основывается на взаимодействии с металлом (медью, марганцем, цинком, гемовым и негемовым железом) в активном центре фермента. Ингибирование усиливается в присутствии иона фосфата, при этом образуется стабильный комплекс фермент – ион металла – фторид – фосфат. В этом комплексе, по-видимому, фторид замещает гидроксильный ион, участвующий в ферментативной реакции присоединения или отнятия молекулы воды. Такой механизм ингибирования был предложен для енолазы (К.Ф. 4.2.1.11), неорганической пирофосфатазы (К.Ф. 3.6.1.1). В случае аконитазы в качестве ингибитора использовался фторацетат, который сам не влиял на протекание реакции. Но образующийся в ходе реакции фторцитрат специфично ингибировал фермент, в то время как его изомер, синтезированный из фтороксалоацетата и ацетилСоА, оказывал слабое влияние на активность аконитазы. Под действием фторида происходит также активация некоторых ферментов, таких как аденилатциклаза (фторид связывался с ионом магния на регуляторной субъединице), фосфодиэстераза сGMP. 6.1.9.3. Бром.Этот элемент попадает в организм в основном в виде неорганических солей: бромидов калия, натрия, кальция и аммония, изредка в виде лекарственных препаратов – бромкамфоры, бромизовала. Бром равномерно распределяется по всему организму. Его физиологическая роль заключается в избирательном влиянии на тормозные процессы в нейронах коры большого мозга. Бром – токсичное соединение. Жидкий бром, попадая на кожу, вызывает ожоги и плохо заживающие язвы. Вдыхание паров брома сопровождается кашлем, развитием бронхоспазма, может вызвать ожог легких и смертельный исход. 6.1.9.4. Йод.Йод, относящийся также к галоидам, присутствует во всех живых организмах. Особенно много накапливают его морские организмы: водоросли (морская капуста, фукус и др.), губки и морские многощетинковые черви. У животных и человека йод обнаруживается в составе тиреоидных гормонов, продуктов щитовидной железы – тироксина (Т4) и трийодтиронина (Т3), влияющих на обмен веществ и в целом на развитие организма. Йод поступает в организм в виде неорганических солей – йодидов калия, натрия и других металлов. Кровью переносится в щитовидную железу, где у животных из неорганического йода образуются органические соединения йода: монойодтирозин (MIT)
Поиск по сайту: |
 (41)
(41)



 (43)
(43) Рис. 6.15. Пространственная струк-тура кальмодулина, состоящего из тандема EF-hand-доменов, связывающих четыре иона кальция (изображены серыми шариками), и центральной α-спирали (согласно [13])
Рис. 6.15. Пространственная струк-тура кальмодулина, состоящего из тандема EF-hand-доменов, связывающих четыре иона кальция (изображены серыми шариками), и центральной α-спирали (согласно [13])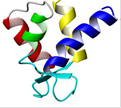




 (46)
(46) (47)
(47)

 (48)
(48)




 (49)
(49) (50)
(50) (51)
(51)
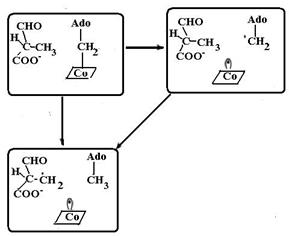 (52)
(52)


 (53)
(53) (54)
(54)




 (55)
(55) (56)
(56) (57)
(57)