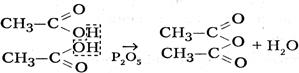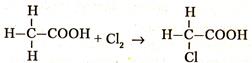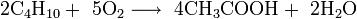|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Физические свойства молока ⇐ ПредыдущаяСтр 2 из 2
-Плотность -Вязкость -Поверхностное натяжение -Осмотическое давление и t замерзания -Электропроводность Применение -лечение язвы желудка и двенадцатиперстной кишки -лучевые поражения -профилактика цитостатического дисбактериоза при лечении больных лимфогранулематозом
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты». Химические Свойства
СН
2 СН
2 СН
СН
2 СН
Получение Уксусную кислоту можно получить окислением ацетальдегида кислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50-60 °С: 2 CH3CHO + O2 → 2 CH3COOH
В промышленности 1.Окислительные методы Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана. Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанол 2.Каталитическое карбонилирование метанола Этим способом получают чуть более 50 % всей промышленной уксусной кислоты 3. Биохимический способ производства При биохимическом производство уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта Применение: Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании. Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении. Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту. Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Гидроксид натрия. Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Nа+)(ОН-). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NаНС03). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз. Хорошо растворим в воде (с экзо-эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов. Химические Свойства: 1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твёрдых веществ: ---c кислотами — с образованием солей и воды: NaOH + HCl → NaCl + H2O (в целом такую реакцию можно представить простым ионным уравнением, реакция протекает с выделением тепла (экзотермическая реакция): OH + H3O → 2H2O.) ---с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении: ZnO + 2NaOH → Na2ZnO2 + H2O так и с растворами: ZnO + 2NaOH(раствор) + H2O → Na2[Zn(OH)4](раствор)+H2 (Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.) NaHCO3 + NaOH → Na2CO3 + H2O (1) H2S + 2NaOH = Na2S + 2H2O (при избытке NaOH) (2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1) 2. Обмена с солями в растворе: 2NaOH +CuSO4 → Cu (OH)2↓ + Na2SO4, 2Na + 2OH + Cu2+ SO42 → Cu(OH)2↓+ Na2SO4 Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе. Его и используют, в частности, для очистки воды от мелких взвесей. 6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4. 6Na + 6OH−+ 2Al3 + SO42→ 2Al(OH)3↓ + 3Na2SO4. 3. С неметаллами: например, с фосфором — с образованием гипофосфита натрия: 4Р + 3NaOH + 3Н2О → РН3 + 3NaH2РО2. 3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O с галогенами: 2NaOH + Cl2 → NaClO + NaCl + H2O(дисмутация хлора) 2Na + 2OH + 2Cl → 2Na + 2O2 + 2H + 2Cl→ NaClO + NaCl + H2O 6NaOH + 3I2 → NaIO3 + 5NaI + 3H2O 4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода: 2Al + 2NaOH + 6H2O → 3H2↑ + 2Na[Al(OH)4] 2Al + 2Na + 8OH+ 6H→ 3H2↑ + 2Na[Al(OH)] 5. С эфирами, амидами и алкилгалогенидами (гидролиз):
---с жирами (омыление), такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века: (C17H35COO)3C3H5 + 3NaOH → C3H5(OH)3 + 3C17H35COONa В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира. 6. С многоатомными спиртами — с образованием алкоголятов: HO-CH2-CH2ОН + 2NaOH → NaO-CH2-CH2-ONa + 2Н2O 7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов): SiO2 + 4NaOH → (2Na2O)·SiO2 + 2H2O. Качественное определение ионов натрия : ---Ионы натрия придают пламени жёлтую окраску ---По цвету пламени горелки — ионы натрия придают пламени жёлтую окраску: ---С использованием специфических реакций на ионы натрия Получение: ---В промышленном масштабе гидроксид натрия получают электролизом растворов галита (каменная соль NaCl) с одновременным получением водорода и хлора: 2NaCl + 2H2О = H2↑ + Cl2↑ + 2NaOH ---В лаборатории гидроксид натрия получают химическими способами, которые имеют больше историческое, чем практическое значение. Известковый способ получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80 °C . Этот процесс называется каустификацией; он описывается реакцией: Na2CO3 + Са (ОН)2 = 2NaOH + CaCO3 В результате реакции образуется раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % NaOH. Расплавленный NaOH разливают в железные барабаны, где он застывает. Ферритный способ описывается двумя реакциями: Na2CO3 + Fe2O3 = Na2O • Fe2O3 + CO2 (1) Na2O • Fe2O3 -f H2O = 2 NaOH + Fe2O3 (2) (1) — процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200 °C. При этом образуется спек-феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции (2); получается раствор гидроксида натрия и осадок Fe2O3, который после отделения его от раствора возвращается в процесс. Раствор содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % NaOH. Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество топлива, получаемый едкий натр загрязнён примесями, обслуживание аппаратов трудоёмко. В настоящее время эти методы почти полностью вытеснены электрохимическим способом производства. Применение: Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: ---Каустик применяется в целлюлозно-бумажной промышленности для делигнификации (сульфатный процесс) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит., ---Для омыления жиров при производстве мыла, шампуня и других моющих средств. ----В химических отраслях промышленности — для нейтрализации кислот и кислотных окислов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке — для производства масел. --- В приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и производстве хлебобулочных изделий.
Вывод: Мы получили слизевую кислоту и изучили ее химические и физические свойства. Вспомнили физические и химические свойства лактозы и карбоновых кислот.
Расчет выхода продукта:
Список использованной литературы:
1.Н. А. Тюкавкина, Ю. И. Бауков. Биоорганическая химия. М.6 «Медицина», 1991 2.Г. П. Хомченко. Пособие по химии для абитуриентов. М.: «Новая волна», 2005. 3. Конспект лекций. 4. wikipedia.org 5. mcd-chemicals.ru 6. «Общая химия», Глинка Н.Л, «Химия», Санкт-Петербург 1982 7.«Основы химии живого» Слесарев В.И., «Химиздат», Санкт-Петербург 2000
Поиск по сайту: |
 СООН + Н
СООН + Н  О = СН
О = СН