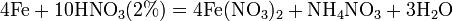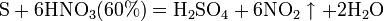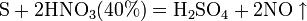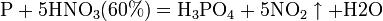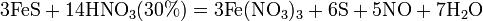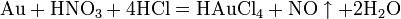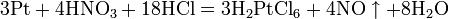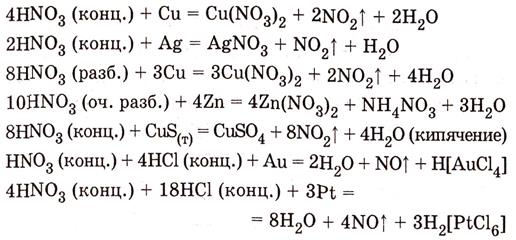|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Химические свойства молокаСтр 1 из 2Следующая ⇒
Выполнение синтеза. 50 мл молока смешивают в стакане с равным объёмом воды и добавляют, помешивая, концентрированную уксусную кислоту (около 0,25 мл) до образования хлопьев выпадающих в осадок белков. Через 10-15 мин фильтруют жидкость через ткань (белое полотно), свободно уложенную в воронку Бюхнера. Несколько миллилитров слегка мутного фильтрата помещают в отдельную пробирку, добавляют 1— 2 мл разбавленного раствора щёлочи и 2-3 капли раствора сульфата меди. При нагревании этой смеси до начала кипения синий цвет исчезает и появляется жёлтый или красный осадок, что указывает на наличие в растворе редуцирующего сахара, в данном случае - лактозы. К остальному фильтрату добавляют 10 мл концентрированной азотной кислоты и нагревают смесь на сетке в стакане или колбе до начала кипения; при этом снова выделяются хлопья: белка и смесь желтеет. Горячую жидкость фильтруют через складчатый бумажный фильтр в колбу. Далее жидкости переливают в фарфоровую чашку, выпаривают на электроплитке до половинного объема, затем на кипящей водяной бане -до остаточного объема 15-20 мл. Полученную жидкость охлаждают и оставляют на 15-20 мин. Слизевая кислота выделяется в виде белого мелкокристаллического осадка на дне чашки, который оставляют на воронке с вкладышем, промывают холодной водой и высушивают. Реактивы:
Приборы и оборудование:
Уравнения реакций, лежащих в основе синтеза: 1)А) Гидролиз лактозы (β-D-галактопиранозил-(1-4)-α/β-D-глюкопираноза):
Б) Окисление галактозы:
2) Реакция лактозы с СuSO4 в щелочной среде
Правила техники безопасности при работе с кислотами и щелочами: 1.Категорически запрещается работать одному в лаборатории, так как в экстренном случае некому будет оказать пострадавшему первую помощь. Работать надо под контролем преподавателя. 2.Необходимо соблюдать тишину, чистоту и порядок. Нельзя отвлекать от работы товарищей. Запрещается держать на рабочем столе посторонние предметы. 3.Категорически запрещается принимать и хранить пищу, пить спиртные напитки и курить. 4.Каждый должен знать, где находятся средства индивидуальной защиты, аптечка, средства для тушения пожаров. 5.В лаборатории необходимо находится в застегнутом хлопчатобумажном халате. 6.Нельзя проводить опыты в загрязнённой посуде. Посуду следует мыть сразу после окончания эксперимента. 7.В процессе работы необходимо следить, чтобы вещества не попадали на кожу, так как многие из них вызывают раздражения и ожоги кожи и слизистых. 8.Все банки, в которых хранятся вещества, должны быть снабжены этикетками. 9.Не разрешается бросать в раковину стёкла от разбитой посуды, бумагу и вату 10.Хранить концентрированные кислоты и щелочи следует в вытяжном шкафу в прочной посуде на поддоне. 11.Все работы с кислотами и щелочами нужно проводить в защитных очках. 12.Концентрированную соляную и азотную кислоты можно переливать только в вытяжном шкафу. Разбавление кислот следует проводить в жаростойкой посуде, при этом кислоту необходимо приливать к воде небольшими порциями, при перемешивании (нельзя приливать воду к концентрированной кислоте, так как в этом случае выделяется большое количество теплоты, воды, как менее плотное вещество, вскипает на поверхности кислоты, и жидкость может быть выброшена из сосуда). 13.При растворении гидроксидов натрия и калия кусочки щелочи можно брать только пинцетом или шпателем, но не руками: растворение этих веществ следует проводить небольшими порциями.
Оказание первой медицинской помощи при ожогах и отравлениях химическими веществами: 1. При термических ожогах первой степени (краснота и припухлость) обожженное место надо обработать спиртовым раствором танина, 96%-ным этиловым спиртом или раствором перманганата калия. При ожогах второй и третьей степени (пузыри и язвы) допустимы только обеззараживающие примочки из раствора перманганата калия, после чего необходимо обратиться к врачу. 2. При ожогах кислотами необходимо промыть пораженное место большим количеством проточной воды, а затем 3%-ным раствором гидрокарбоната натрия, после чего — снова водой. 3. При ожогах щелочами нужно промыть очаг поражения проточной водой, а затем разбавленным раствором борной или уксусной кислоты. 4. При попадании щелочи или кислоты в глаза необходимо промыть их проточной водой (3 - 5 мин), а затем раствором борной кислоты (в случае попадания щелочи) или гидрокарбоната натрия (в случае попадания кислоты), после чего обратиться к врачу.
Физические и химические свойства всех веществ,использовавшихся в данной методике. Вода́(оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме), запаха и вкуса (при нормальных условиях). Химическая формула: Н2O. Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы). Химические свойства: 1) Вода реагирует со многими металлами с выделением водорода: 2Na + 2H2O = H2 + 2NaOH(бурно) 2K + 2H2O = H2 + 2KOH(бурно) 3Fe + 4H2O = 4H2 + Fe3O4(только при нагревании) Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре: C + H2O = H2 + CO(при сильном нагревании) CH4 + 2H2O = 4H2 + CO2(при сильном нагревании) 2) Вода разлагается на водород и кислород при действии электрического тока.
3) Вода реагирует со многими оксидаминеметаллов.
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой.
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Это ZnO, TiO2, Cr2O3. Оксиды железа также не растворимы в воде и не реагируют с ней. 5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
Приведем другие примеры образования гидратов: H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты) NaOH + H2O = NaOH.H2O (гидрат едкого натра) 6) Особая реакция воды – синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода: 6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света) Лактоза- С12Н22О11 — углевод группы дисахаридов, содержится в молоке и молочных продуктах. Молекула лактозы состоит из остатков молекул глюкозы и галактозы. Химические свойства лактозы: 1. Синтез лактозы
2.Мутаротация: - это изменение во времени узла вращения плоскости поляризации света. В кристаллическом виде моно- и ди- сахариды существуют в виде a-аномеров, при растворение в следствии цикло-оксо-таутомерии они превращаются в более устойчивые b-аномеры. Поэтому в свежеприготовленном растворе сахарида с течением времени изменяется величина и направление луча плоскополяризованного света. Эти изменения наблюдаются до тех пор, пока 60% вещества не перейдут в более устойчивую форму.
3. Реакция алкилирования:
4.Реакция со спиртами в присутствии H+:
5.Гидролиз:
6.Циклаоксатаутомерия:
Физические свойства: Лактоза (молочный сахар) С12Н22О11 — углевод группы дисахаридов, содержится в молоке. Молекула лактозы состоит из остатков молекул глюкозы и галактозы. Получают лактозу из сыворотки молока. Применяют для приготовления питательных сред, например при производстве пенициллина. Из лактозы получают лактолозу - ценный препарат для лечения кишечных расстройств.
Азо́тная кислота́ (HNO3), — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Химические свойства азотной кислоты: Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией). Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3 как сильная одноосновная кислота взаимодействует: а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует: а) с металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3. Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот: увеличение концентрации к-ы С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
Некоторые металлы (железо, хром, алюминий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию. Смесь азотной и серной кислот носит название «меланж». Азотная кислота широко используется для получения нитросоединений. Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
Важнейшие реакции:
Применение -в производстве минеральных удобрений; -в военной промышленности; -в фотографии — подкисление некоторых тонирующих растворов[2]; -в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише). -в производстве взрывчатых и отравляющих веществ Действие на организм Азотная кислота и её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета).
Сульфат меди: (CuSO4) — белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO4 · 5H2O — медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения. Получение: В промышленности- растворением Cu и медных отходов в разб. H2SO4 при продувании воздуха; растворением CuO в H2SO4; сульфатизирующим обжигом сульфидов Cu; как побочный продукт электролитич. рафинирования Cu. CuO + H2SO4→ CuSO4 + H2O 2Cu + O2 + 2H2SO4→ 2CuSO4 + 2H2O В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании: Cu + 2H2SO4→ CuSO4 + SO2↑ + 2H2O Температура не должна превышать 60 градусов Цельсия так как образуется побочный продукт: 5Cu + 4H2SO4→ 3CuSO4 + Cu2S + 2H2O Химические Свойства: 1.Взаимодействует с активными металлами: СuSO4+Fe => FeSO4+Cu 2.Взаимодействие с щелочами: CuSO4+2NaOH => Cu(OH)2+Na2SO4 Молоко́ — питательная жидкость,вырабатываемая молочными железами самок млекопитающих. Естественное предназначение молока — вскармливание детёнышей (в т.ч. у человека - см. Грудное вскармливание), которые ещё не способны переваривать другую пищу. В настоящее время молоко входит в состав многих продуктов, используемых человеком, а его производство стало крупной отраслью промышленности. Молоко — многокомпонентная полидисперсная система, в которой все составные вещества находятся в тонкодисперсном состоянии, что обеспечивает молоку жидкую консистенцию. Технический регламент определяет молоко как продукт нормальной физиологической секреции молочных желез сельскохозяйственных животных, полученный от одного или нескольких животных в период лактации при одном и более доении, без каких-либо добавлений к этому продукту. Химические свойства молока -Кислотность -Буферность -Окислительно-восстановительный потенциал
Поиск по сайту: |









 С6Н12О6 + С6Н12О6 С12Н22О11 + Н2О глюкоза галактоза лактоза вода
С6Н12О6 + С6Н12О6 С12Н22О11 + Н2О глюкоза галактоза лактоза вода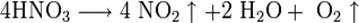

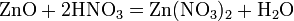
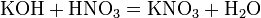
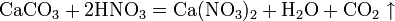
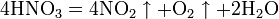


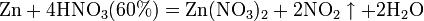

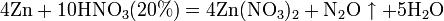

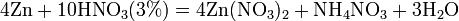
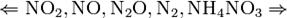 увеличение активности Ме
увеличение активности Ме