|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Специфические свойства оксикислот ⇐ ПредыдущаяСтр 2 из 2
1. Отношение оксикислот к нагреванию. Оксикислоты в зависимости от положения ОН-группы по разному себя ведут при нагревании. Это позволяет отличить α, β, γ и другие оксикислоты друг от друга, а) α-гидроксикислоты:
В случае α-оксикислот происходит взаимодействие между двумя молекулами кислоты, при этом выделяются две молекулы воды, и образуется циклический сложный эфир, который называется лактидом. б) β-гидроксикислоты:
На β-углеродном атоме электронная плотность уменьшается, вследствие чего водород становится подвижен – отщепляется молекула воды и образуется непредельная кислота. Таким образом β-оксикислоты образуют α, β-непредельные кислоты. в) γ-гидроксикислоты:
При нагревании γ-гидроксикислоты претерпевают внутримолекулярную циклизацию с образованием циклических сложных эфиров, которые называются лактонами Расщеплении α-гидроксикислот: Для α-оксикислот характерна еще одна специфическая реакция. При действии концентрированной серной кислоты а-оксикислоты разлагаются с разрывом С-С связи:
В этих условиях, как правило, образуется муравьиная кислота и соответствующий альдегид или кетон. Образовавшаяся муравьиная кислота при действии концентрированной серной кислоты и нагревании разлагается с выделением оксида углерола (II) и воды. Это реакция используется для определения α-гидроксикислот. Несколько слов о молочной кислоте, так как из α-гидроксикислот она имеет наиболее важное значение. МОЛОЧНАЯ КИСЛОТА (α-оксипропионовая)
Она содержится в кислом молоке, откуда и получила свое название. В промышленности молочную кислоту получают молочнокислым брожением углеводов:
Получают молочную кислоту и при восстановлении пировино-градной кислоты:
В молочной кислоте содержится один ассиметрический атом углерода. Поэтому она существует в виде двух оптических изомеров:
Представителями двухосновных гидроксикислот являются яблочная (оксиянтарная) кислота и винная (диоксиянтарная) кислота.
яблочная кислота Яблочная кислота – это двухосновная трехатомная кислота. Молекула яблочной кислоты содержит один асимметрический атом углерода, поэтому существует в виде двух оптических изомеров и оптически неактивной рацемической форме:
В природе встречается L(–)-яблочная кислота.
ВИННАЯ КИСЛОТА Винная кислота – двухосновная, четырехатомная. Молекула винной кислоты содержит два асиметрических атома углерода и существует в виде трех стереоизоизомеров: D-винная кислота, L-винная кислота и мезовинная кислота.
При хранении вина она выделяется в виде нерастворимой кислой калиевой соли (калий виннокислый).
ЛИМОННАЯ КИСЛОТА Это четырехатомная, трехосновная кислота. Относится к α-гидроксикислотам. Как и все α-оксикислоты. лимонная кислота при нагревании с концентрированной H2SO4 разлагается с выделением муравьиной кислоты и ацетонадикарбоновой кислоты:
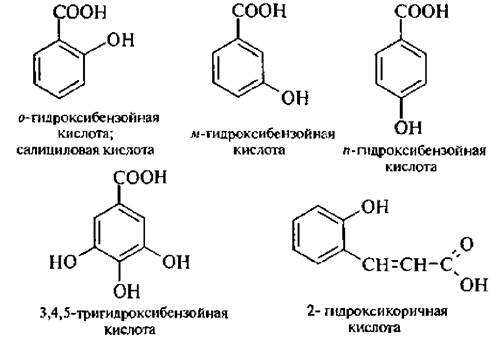
Ацетондикарбоновая кислота при нагревании декарбоксилируется с образованием ацетона. Соли лимонной кислоты называют цитратами. Лимонная кислота, также как и винная, относится к пищевым кислотам. Цитрат натрия используется при консервировании крови. ФЕНОЛОКИСЛОТЫ Фенолокислотами называют производные аренкарбоновых кислот, у которых один или несколько атомов водорода в ароматическом ядре замещены на гидроксильную группу, то есть это соединения, которые содержат фенольную и карбоксильную группы. Например:
Даже если карбоксильная группа находится в боковой цепи, но в молекуле содержится фенольный гидроксил, – это тоже фенолокислоты. Способы получения 1. Сплавлением сульфобензоиных кислот со щелочами:
2. Карбоксилирование фенолов оксидом углерода (IV) (Реакция Кольбе – Шмитта). Нагревание фенолов в щелочной среде с оксидом углерода (IV) приводит к образованию салициловой кислоты:
Для двухатомных фенолов присоединение СО2 идет более легко:
Физические свойства Фенолоксикислоты – кристаллические вещества, труднорастворимые в воде, перегоняются с водяным паром. Они более сильные кислоты, чем бензойные, с FeCl3 дают фиолетовое окрашивание. Химические свойства В химическом отношении это бифункциональные соединения. Они дают все производные по функциональным группам:
В реакцию с гидрокарбонатом натрия вступает только карбоксильная группа. При этом образуется мононатриевая соль салициловой кислоты, а при действии щелочей образуется динатриевая соль салициловой кислоты. Благодаря близости двух функциональных групп в молекуле салициловая кислота, в отличие от своих изомеров, взаимодействует с гид-роксидом меди (II):
С участием карбоксильной группы протекают реакции со спиртами, галогенирующими реагентами:
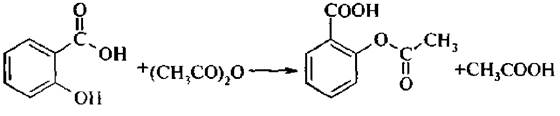
При взаимодействии салициловой кислоты с уксусным ангидридом образуется ацетилсалициловая кислота:
Салициловая кислота по кислотным свойствам превосходит бензойную кислоту, а также о- и п-гидроксибензойные кислоты. Это можно объяснить тем, что происходит дополнительная стабилизация салицилат-иона за счет образования внутримолекулярной водородной связи:
При нагревании салициловая кислота легко декарбоксилируется:
Производные салициловой кислоты используются в качестве анальгетических, жаропонижающих и противовоспалительных средств, например:
ОКСОКИСЛОТЫ К оксокислотам относятся альдегид о- и кетонокислоты. Уже самоназвание указывает на то, что в структуру соединений входит карбоксильная группа и альдегидная или кетонная группы. В зависимости от взаимного расположения функциональных групп различают α, β, γ и т. д. оксокислоты. Наиболее важными представителями альдегидо- и кетонокислот являются:
Оксокислоты получают окислением гидрокс и кислот. При окислении гилроксикислот, содержащих первичный спиртовой гидроксил, образуются альдегилокислоты, а при окислении гидроксикислот со вторичным спиртовым гилроксилом образуются кетонокислоты:
Пировиноградную кислоту также получают из виноградной, то есть из рацемической смеси винных кислот, при нагревании (пирос – нагревание).
Вначале происходитдекарбоксилирование и образуется глицериновая кислота, которая теряет воду с образованием непредельной оксикарбоновой кислоты как промежуточного соединения, В свободном состоянии такая кислота существовать не может. Согласно правилу Эльтекова, гидроксильная группа не может находиться при углероде с двойной связью в открытой цепи, так как имеет место сопряжение неподеленной пары электронов атома кислорода с р-электронами двойной связи. Атом водорода становится протонированным и переходит к атому углерода СН2-группы, при этом образуется пировиноградная кислота. α-Оксикислоты легко декарбоксилируются в присутствии концентрированной серной кислоты, превращаясь при этом в альдегиды:
Пировиноградная кислота применяется в синтезе гетероциклов и целого ряда фармацевтических препаратов (атофан). Это жидкость не очень приятного запаха. Ацетоуксусная кислота относится к β-оксокислотам, обладает свойствами кетонов и свойствами карбоновых кислот.
Если сравнивать рКа пировиноградной кислоты и анетоуксусной, то следует отметить, что рКа пировиноградной кислоты выше, чем у ацетоуксусной. Это объясняется удаленностью С=O группы от СООН в ацетоуксусной кислоте. Второе свойство этой кислоты – легкое декарбоксилирование:
Декарбоксилирование происходит уже при комнатной температуре или при незначительном нагревании. В отличие от кислот, сложные эфиры β-кетонокислот являются устойчивыми соединениями. Этиловый эфир β-кетомасляной кислоты называют ацетоуксусным эфиром:
Ацетоуксусный эфир получают по реакции Кляйзена. Исходным продуктом в этой реакции является этиловый эфир уксусной кислоты. Катализирует этот процесс алкоголят натрия. Эта реакция походит на альдольную конденсацию. Этилат натрия реагирует с этиловым эфиром уксусной кислоты:
Образовавшийся карбанион реагируете молекулой сложного эфира по карбэтоксильной группе:
Ацетоуксусиый эфир – таутомерное соединение, для него характерна кето-енольная таутомерия, которая обусловлена наличием подвижных атомов водорода метиленовой группы:
Между этими двумя формами устанавливается динамическое (подвижное) равновесие. Кетонная форма более выгодна в энергетическом отношении и поэтому ее значительно больше. Наличие кетонной и енольной форм доказывается с помощью химических реакций. Кетоформа ацетоуксусного эфира взаимодействует с гидроксиламином с образованием оксима; восстанавливается водородом в момент выделения и дает другие реакции кетонов:
Существование енольной формы доказывается образованием красного окрашивания с FeCI3, обесцвечиванием бромной воды:
Для ацетоуксусного эфира характерно два типа расщеплений: кетонное и кислотное. Кетонное расщепление протекает под влиянием разбавленных кислот или щелочей. Называется кетонным, так как образуются при этом кетоны:
В этих условиях происходит гидролиз по сложноэфирной группе, образуется ацетоуксусная кислота, которая декарбоксилируется с образованием кетона. Кислотное расшепление протекает под влиянием концентрированных растворов щелочей.
Ацетоуксусный эфир широко применяется для получения различных кетонов или кислот, например:
Таким образом, из ацетоуксусного эфира мы получили натриевую соль изомасляной кислоты и метилизопропилкетон. Ацетоуксусный эфир широко применяется в синтезе многих лекарственных препаратов.
АМИНОКИСЛОТЫ Это производные кислот, в молекуле которых один или несколько атомов водорода в радикале замешены на группу NH2. По положению группы NH, аминокислоты делятся на а, р\ у и т. д.
Ароматические аминокислоты бензольного ряда рассматривают как производные бензойной кислоты:
Способы получения 1. Гидролиз белков. Таким способом получают 31 аминокислоту, из них 30 α-аминокислот и одну β-аминопропионовую кислоту. 2. Действием NH3 на галогенокарбоновые кислоты. При этом получают различные (α, β, γ) аминокислоты в зависимости от положения галогена. 3. Метод Зелинского– Стадникова. В процессе реакции образуется 2-аминопропанонитрил, который гидролизуется до кислоты:
Этим способом получают только α-аминокислоты. 4. Присоединение NH3 к непредельным карбоновым кислотам. Реакция присоединения протекает против правила Марковникова.
5. Восстановление нитробензоиных кислот.
В молекуле аминокислоты содержится кислотный центр –СOOH-группа и основный центр –NH2-rpynna, поэтому аминокислоты кристаллизуются из водных растворов в виде внутримолекулярных солеи:
В химическом отношении аминокислоты обладают свойствами карбоновых кислот и первичных аминов. Они взаимодействуют и с кислотами, и со щелочами, т. е. проявляют амфотерные свойства:
Поиск по сайту: |