|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГИДРОКСИКИСЛОТЫ (СПИРТОКИСЛОТЫ, ФЕНОЛОКИСЛОТЫ)Стр 1 из 2Следующая ⇒
ГАЛОГЕНОКАРБОНОВЫЕ КИСЛОТЫ Галогенокарбоновыми кислотами называют производные карбоновых кислот, которые в углеводородном радикале содержат один или несколько атомов галогена. По природе углеводородного радикала различают алифатические, алициклические и ароматические галогенокарбоновые кислоты. Алифатические галогенокарбоновые кислоты по взаимному расположению атома галогена и карбоксильной группы делятся на: α, β, γ, δ и т. д. Например:
Способы получения 1. Действие галогенов на органические кислоты.
В этом случае, как правило, получают сс-галогеносодержащие карбоновые кислоты. 2. Реакция Геля – Фольгарда – Зелинского. Этот способ имеет бол ь-шое значение. Он заключается в действии галогена на предельные карбоновые кислоты в присутствии фосфора.
Реакция Геля – Фольгарда – Зелинского осуществляется значительно легче, чем в предыдущем случае. На первой стадии образуется бромангидрид уксусной кислоты. Бром в значительной степени усиливает смещение электронной плотности от α-утлеродного атома. Водороды при α-углеродном атоме становятся более подвижны и легко замешаются на галоген. Образовавшийся бромангидрид бромуксусной кислоты при взаимодействии с водой образует бромуксусную кислоту. 3. Действие галогеноводородов на непредельные карбоновые кислоты.
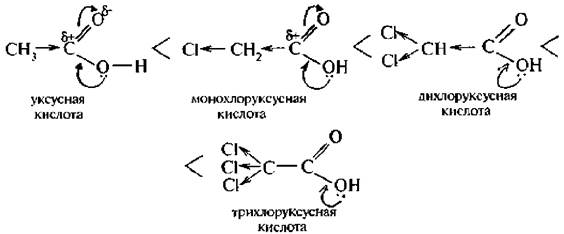
Реакция присоединения протекает против правила Марковникова. Физические свойства Галогенокарбоновые кислоты – это бесцветные жидкости или кристаллические вещества, хорошо растворимые в воде; с увеличением молекулярной массы растворимость кислот в воде уменьшается. Химические свойства Гадогенокарбоновые кислоты более сильные кислоты, чем карбоновые. Введение галогенов в молекулу увеличивает силу кислот.
Сила кислот зависит от величины дробного положительного заряда на атоме углерода карбоксильной группы. А величина δ+ увеличивается с введением галогенов, которые обладают отрицательным индуктивным эффектом. Например, трихлоруксусная кислота по силе приравнивается к серной кислоте. Значит, сила кислоты зависит от количества атомов галогена в углеродном радикале. Кроме того, сила кислоты зависит от положения галогена в цепи. Поскольку индуктивное смешение эффективно на протяжении четырех – пяти σ-свкзей, то α-галогенокарбоновые кислоты более сильные, чем β-, а β– сильнее, чем у-гадогенокарбоновые кислоты. Для галогенокарбоновых кислот характерны реакции по карбоксильной группе и реакции с участием атома галогена. По карбоксильной группе они образуют все функциональные производные карбоновых кислот: соли, сложные эфиры, ангидриды, галогенангидриды, амиды и др. Например:
Алифатические галогенокарбоновые кислоты, подобно галогеналканам, вступают в реакции замещения галогена по механизму нуклеофильного замещения (SN). Причем, подвижность галогена зависит от взаимного расположения галогена и карбоксильной группы. Карбоксильная группа, как электроакцепторная группа (-I), увеличивает подвижность атома галогена в молекуле:
Больше всего галоген будет подвижен при α-углеродном атоме. Подвижность атома галогена можно подтвердить целым рядом реакций:
Галоген в β-положении менее подвижен, а в γ-положении влияние карбоксильной группы практически не сказывается. Галогенокарбоновые кислоты находят широкое применение для получения окси- и аминокислот, широко используются в органическом синтезе лекарственных препаратов, например: уреид α-бромизовалериановой кислоты – бромизовал – это снотворный препарат
ГИДРОКСИКИСЛОТЫ (СПИРТОКИСЛОТЫ, ФЕНОЛОКИСЛОТЫ) Гидроксикислоты – это производные карбоновых кислот в молекуле которых помимо карбоксильной группы содержится одна или несколько гидроксилъных групп. Для них вводятся понятия основность и атомность. Основность определяется числом карбоксильных групп в молекуле, а атомность – общим числом гидроксилькых групп, включая гидроксильную группу карбоксила. Например:
Для названия гидроксикислот наряду с заместительной номенклатурой широко применяются тривиальные названия. По заместительной номенклатуре ИЮПАК за родоначальную структуру принимается кислота, а положение гидроксильной группы в молекуле обозначают буквами греческого алфавита или цифрами. По положению гидроксильноЙ группы относительно карбоксильной гидрокислоты делятся на α, β, γ и т. д.
Способы получения 1. Окисление гликолей. Для проведения этой реакции берется такое количество окислителя, чтобы не затронуть вторую гидроксильную группу.
2. Гидролиз галогенкарбоновых кислот.
Эти способы дают возможность получать α, β, γ, δ-оксикислоты. 3. Омыление циангидринов альдегидов и кетонов.
Обычно этим спосооом получают α-оксикислоты. 4. Восстановление кетонокислот.
Физические свойства Это вязкие бесцветные жидкости или кристаллические вещества, хорошо растворимые в воде. Химические свойства Гидроксикислоты обладают более сильными кислотными свойствами, по сравнению с незамещенными карбоновыми кислотами. Сила кислоты зависит от положения гидроксильной группы в молекуле и уменьшается в следующем порядке: α > β > γ > δ, то есть α-гидроксикарбоновые кислоты более сильные, чем β-, а β– сильнее, чем γ и т. д.
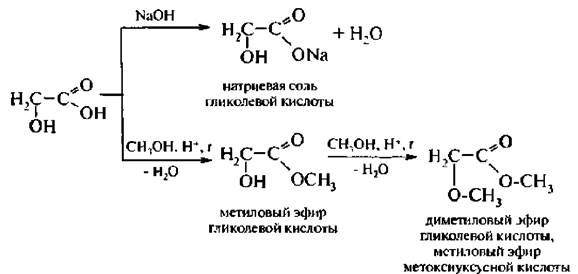
Со стороны гидроксильной группы проявляется -I-эффект. За счет этого увеличивается δ+ заряд на углероде карбоксильной группы. По мере удаления гидроксильной группы от карбоксильной снижается ее влияние и сила кислоты уменьшается. Оксикислоты образуют все производные по карбоксильной группе и вступают в реакции с участием спиртового гидроксила. Кто хорошо знает свойства спиртов и кислот, тот легко усвоит свойства оксикислот. К примеру, по СООН-группе гидроксикислоты образуют хлоран гидриды, сложные эфиры, соли, ангидриды и др.:
В реакцию со спиртами, прежде всего, вступает карбоксильная группа и образуется сложный эфир, затем может вступить и ОН-группа с образованием диэфира. С участием гидроксильной группы гидрокси кислоты алифатического ряда вступают в реакции, характерные для спиртов:
В результате взаимного влияния гидроксильной и карбоксильной групп появляются и новые свойства у оксикислот.
Поиск по сайту: |