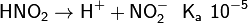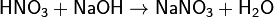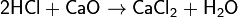|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Равновесные процессы в водных растворах ⇐ ПредыдущаяСтр 2 из 2
Химические свойства кислот определяются способностью их молекул диссоциировать в водной среде с образованием гидратированных ионов H+ и анионов кислотных остатков А–:
В зависимости от значения константы химического равновесия, также называемой константой кислотности Ka, выделяют сильные и слабые кислоты:
Из числа распространённых кислот к сильным относятся хлорная, азотная, серная и хлороводородная. Азотистая HNO2, угольная H2CO3 (CO2·H2O), фтороводородная HF – примеры слабых кислот. Также используется более детальная классификация по значению Ka на очень слабые (≤10-7), слабые (~10-2), средней силы (~10-1), сильные (~103), очень сильные (≥108). Для неорганических кислородсодержащих кислот вида HnXOm известно эмпирическое правило, по которому значение первой константы связано со значением (m – n). При (m – n) = 0 кислота очень слабая, при 1 - слабая, при 2 - сильная, и, наконец, при 3 - кислота очень сильная:
Данная закономерность обусловлена усилением поляризации связи Н-О вследствие сдвига электронной плотности от связи к электроотрицательному атому кислорода по подвижным π-связям Э=O и делокализациейэлектронной плотности в анионе. Неорганические кислоты обладают свойствами, общими для всех кислот, среди которых: окрашивание индикаторов, растворение активных металлов с выделением водорода (кроме HNO3), способность реагировать с основаниями и основными оксидами с образованием солей, например:
Число атомов водорода, отщепляемых от молекулы кислоты и способных замещаться на металл с образованием соли, называется основностью кислоты. Кислоты можно разделить на одно-, двух- и трехосновные. Кислоты с более высокой основностью неизвестны. Одноосновными являются многие неорганические кислоты: галогеноводородные вида HHal, азотная HNO3, хлорная HClO4, роданистоводородная HSCN и др. Серная H2SO4, хромовая H2CrO4, сероводородная H2S служат примерами двухосновных кислот и т. д. Многоосновные кислоты диссоциируют ступенчато, каждой ступени отвечает своя константа кислотности, причем всегда каждая последующая Кa меньше предыдущей ориентировочно на пять порядков. Ниже показаны уравнения диссоциации трехосновной ортофосфорной кислоты:
Основность определяет число рядов средних и кислых солей − производных кислоты[4]. К замещению способны только атомы водорода, входящие в состав гидроксигрупп −OH, поэтому, например, ортофосфорная кислота H3PO4 образует средние соли - фосфаты вида Na3PO4, и два ряда кислых − гидрофосфаты Na2HPO4 и дигидрофосфаты NaH2PO4. Тогда как, у фосфористой кислоты H2(HPO3) только два ряда − фосфиты и гидрофосфиты, а у фосфорноватистой кислотыH(H2PO2) − только ряд средних солей − гипофосфитов. Исключение составляет борная кислота H3BO3, которая в водном растворе существует в виде одноосновного гидроксокомплекса:
Современные теории кислот и оснований значительно расширяют понятие кислотных свойств. Так, кислота Льюиса — вещество, молекулы или ионы которого способны принимать электронные пары, в том числе и не содержащие ионов водорода: например, катионы металлов (Ag+, Fe3+), ряд бинарных соединений (AlCl3, BF3, Al2O3, SO3, SiO2). Протонные кислоты рассматриваются теорией Льюиса как частный случай класса кислот. Органические кислоты
Органические кислоты можно рассматривать как продукты замещения водородных атомов предельных углеводородов (см. Парафины) карбоксильными группами. Смотря по числу последних различают кислоты П. одноосновные, общей формулы CnH2n+1CO2H (кислоты жирные по преимуществу; см.), и кислоты П. многоосновные, общей формулы CnH2n+2-m—(CO2H)m; как в тех, так и в других в углеводородных остатках CnH2n+1 и CnH2n+2-m один или несколько атомов водорода могут быть замещены: гидроксилами (см.), при чем получаются оксикислоты (см. ниже), или амидогруппами (NH2)', при чем образуются амидокислоты или глицины (см. Гликоколь), или нитрогруппами (NO2)' и т. д. Кислоты П. одноосновные (и одноатомные) образуются с сохранением числа углеродных атомов в частице: 1) при окислении первичных [Известен случай образования (небольш. количество) П. кислоты и при окислении третичного спирта: (CH3)3C(OH) + O2 (триметилкарбинол) = (CH3)2—CH—CO2H + H2O (изомасляная кислота) (Бутлеров).] П. спиртов и альдегидов: 2CH3—CH2(OH) + O2 = 2CH3—CH(OH)2 [Гликоль такого строения гипотетичен и никем пока получен не был, но эфирные производные, ему отвечающие (ацетали), при окислении спиртов образуются.]; 2CH3—CH(OH)2 — 2H2O = 2CH3—COH (альдегид) и 2CH3—COH + O2 = 2CH3—COOH (кислота уксусная); реакция рассматривается обыкновенно как последовательное окисление водородных атомов того углеродного атома, с которым уже был ранее соединен кислородный атом; окисление ведут, действуя на спирт (альдегид) смесью двухромовокалиевой соли с серной кислотой; спирты с большой частицей могут давать П. кислоты (Ca и Na соли) при нагревании с натристой известью (Дюма и Стас, Гелль): C15H31—CH2(OH) (эталь) + NaOH = C15H31—CO2Na (пальмитиновая соль)+ 2H2; 2) при действии водорода in st. nasc. на непредельные кислоты: CH2=C(CH3)—CO2H (метакриловая кислота, см. Кротоновая кислота) + H2 = (CH3)2—CH—CO2H (изомасляная кислота; Фиттиг и Пауль), а равным образом на галоидозамещенные П. кислоты: CCl3—CO2H (трихлоруксусная кислота) + 3H2 = CH3—CO2H (уксусная кислота) + 3HCl (Мельсанс) и на П. оксикислоты: CH3—CH(OH)—CO2H (молочная кислота) + 2HI = CH3—CH2—CO2H + I + H2O, а так как оксикислоты могут быть получены из кетонокислот, глицинов и из нитрокислот (через глицины), то, следовательно, П. кислоты могут быть получены и из всех этих соединений; П. кислоты образуются еще: 3) "омылением" оответственных нитрилов: HCN (цианистый водород) + 2H2O = H2CO2 (муравьиная кислота) + NH3 или H3C—CN + 2H2O = CH3—CO2H + NH3 (Кольбе и Франкланд). Синтетическими реакциями образования П. кислот являются: 4) действие углекислого газа на натрийорганические соединения (Ванклин): CH3Na + CO2= CH3—CO2Na (см.); 5) действие окиси углерода (при 160°—200°) на алкоголяты натрия (Гейтер, Пётч): CH3—CH2(ONa) + CO = CH3—CH2—CO2Na, реакция, отвечающая образованию муравьиной соли при действии окиси углерода (при 100° Ц.) на раствор едкой щелочи (Бертело): CO + KOH = HCO2K, окиси же углерода (при 200° Ц.) на натристую известь (Мерц и Тибирица) [Реакция предложена как техническая. Реакция CO с алкоголятами высших спиртов идет очень негладко (Пётч).]; 6) действие хлорокиси углерода на цинкорганические соединения (Бутлеров): Zn(CH3)2 + 2COCl2 = 2CH3—COCl + ZnCl2 и 2CH3—COCl + 2H2O = 2CH3—COOH + 2HCl; [Условия этой реакции в точности не известны; А. М. Бутлерову только раз, при получении триметилкарбинола из COCl2 и Zn(CH3)2, удалось наблюдать образование CH3—CO2H.]; 7) электролиз раствора смеси калиевых солей П. одноосновной кислоты и П. двухосновной эфирной кислоты (Миллер и Гоффер):
П. одноосновные кислоты являются продуктами распадения: 8) одно- и двузамещенных ацетоуксусных эфиров под влиянием концентрированной спиртовой щелочи (Франкланд и Дюппа, И. Вислиценус): CH3—CO—CHR—CO2C2H5 + 2KOH = CH3—CO2K + CH2R—CO2K + C2H5(OH) и CH3—CO—CR2CO2C2H5 + 2KOH = CH3—CO2K + CHR2—CO2K + C2H5(OH); 9) одно- и двузамещенных малоновых кислот (см.) при нагревании (Конрад): HO2C—CHR—CO2H = CO2 + HO2C—CH2R и HO2C—CR2—CO2H = CO2 + HO2C—CHR2; 10) бариевых солей двухосновных кислот при нагревании с метилатом натрия (Май; ср. Парафины): HO2C—CH2—CH2—CO2H = CO2 + HO2C—CH2—CH3 или свободных кислот под влиянием солнечного света в присутствии урановых солей (Зеекамп): HO2C—CH2—CH2—CO2H = CO2 + HO2C—CH2—CH3; 11) непредельных кислот этиленного ряда при плавлении с едким кали (Варрентрапп, Гейтер, Марассе, Кекуле, Фиттиг): CH3—CH=CH—CO2H + 2KOH = CH3—CO2K + CH3—CO2K + H2; 12) П. кетонов при окислении их двухромовокалиевой солью с серной кислотой (Попов, Вагнер): 2CH3—CO—CH3 + 3O2 = 2CH3—CO2H + 2H—CO2H; 13) П. кетонов же, переходя через оксимы (Бекманн, В. Мейер и Уоррингтон; ср. Кетоны): (СР3)2—CH—C(N—OH)—CH—(CH3)2 = (CH3)2—CH—CO—NH—CH—(CH3)2 и (CH3)2—CH—CO—NH—CH—(CH3)2 + HOH = (CH3)2—CH—CO(OH) + H2N—CH—(CH3)2 и 14) некоторых олефинов (см.) при окислении; так, например, триметилуксусная кислота (CH3)3C—CO2H получена Бутлеровым при окислении диизобутилена C8H16 и триизобутилена C12H24. Из перечисленных реакций для получения кислот 1, 3 и 9 идут наиболее гладко и потому чаще других применяются. Некоторые П. одноосновные кислоты встречаются в свободном состоянии в природе (например, Муравьиная кислота) и очень многие в виде эфиров глицерина, входя в состав жиров и масел; уксусная кислота образуется при брожении спирта обыкновенного, а нормальная масляная и каприловая при брожении молочнокислого кальция (маслянокислое брожение;). Низшие члены предельных кислот при обыкновенной температуре (+20° Ц.) жидки; начиная с каприловой кислоты CH3—(CH2)8—CO2H (плавится при 31,4°), они тверды; правильности в точках плавления подмечены только для кислот нормального ряда, т. е. содержащих только одну метильную группу, соединенную с карбоксилом через посредство цепи групп (CH2)', а именно В. Мейер и Якобсон (1893) и Массоль (1896) указали, что они расположены на двух кривых; верхняя отвечает точкам плавления кислот с четным числом атомов углерода, а нижняя — с нечетным (ср. Парафины); кислотам, содержащим C4 и С5, отвечают в обеих кривых минимумы; начиная с C6 и C7 кривые идут почти параллельно до C18 и C19; выше замечается некоторая неправильность, но температуры плавления высших кислот нельзя считать достоверно установленными. [По Мари, церотиновая кислота содержит не C27, a C25; в таком случае ее точка плавления наблюдена вполне правильно.]
Одноосновные кислоты Одноосновные кислоты, карбоксильная группа которых находится в ядре. Одноосновные кислоты будут рассматриваться в такой последовательности: жирные, замещенные уксусной кислоты, ароматические кислоты, ненасыщенные кислоты, кетонокислоты, о-гете-роциклические кислоты, лактоновые кислоты, N-гетероцикличе-ские кислоты. Одноосновная кислота ( например, НС1, HNO3) при растворении в воде отщепляет один ион водорода. Одноосновные кислоты называют также монокарбо-новыми, а двухосновные - дикарбоновыми кислотами. Одноосновные кислоты ( например, НС1, HCN, HBr, HN03 и др.) не образуют кислых солей. Одноосновные кислоты с алкильным или алкенильным радикалом называют жирными кислотами, так как некоторые из них в виде сложных эфиров входят в состав растительных и животных жиров и масел. Одноосновные кислоты не образуют кислых солей. Одноосновная кислота диссоциирует на ионы в одну ступень. Одноосновные кислоты и двухосновные, карбоксилы которых разделены более чем двумя атомами углерода, во многих случаях могут быть превращены в ангидриды нагреванием с водоотнимающими средствами. Одноосновные кислоты и основания характеризуются одной константой электролитической диссоциации. Для двухосновных и трехосновных кислот и оснований известно более одной константы диссоциации соответственно числу ступеней электролитической диссоциации. Одноосновные кислоты более чем с двумя атомами углерода рассматривают как производные уксусной кислоты, образованные замещением атомов водорода в ее метильной группе углеводородными радикалами. Пропио-новая кислота может быть названа метилуксусной, масляная - этилуксусной, изомасляная - диметилуксусной. Подобно альдегидам за основу рационального названия кислоты изострое-ния можно принять тривиальное название нормальной кислоты; соответствующей наиболее длинной цепи, включающей карбоксильный углерод. Одноосновные кислоты с алкильным или алкенильным радикалом называют жирными кислотами, так как некоторые из них в виде сложных эфиров входят в состав растительных и животных жиров и масел. Одноосновные кислоты с алкильным или алкенильным радикалами называют жирными, кислотами, так как некоторые из них в виде сложных эфиров входят в состав растительных и животных жиров и масел. Одноосновные кислоты с алкильным или алкенильным радикалами называют жирными кислотами, так как некоторые из них в виде сложных эфиров входят в состав растительных и животных жиров и масел. Одноосновные кислоты могут быть получены из так называемых малоновых двухосновных кислот, содержащих две карбоксильные группы при одном атоме углерода. Такие кислоты при незначительном нагревании выделяет СО2 и дают соответствующую одноосновную кислоту.
Двухосновная кислота Двухосновные кислоты значительно сильнее одноосновных. Щавелевая сильнее муравьиной в 300 раз, а малоновая - в сто раз сильнее уксусной. Двухосновная кислота C7Hi2 ( C02H) 2, так как по аналогии с изоборниланом при окислении В-метилкамфенилана указанного строения ( X) азотной кислотой одна из метильных групп должна окислиться. Образующаяся при этом двухосновная кислота должна быть тождественна апофенхокамфорной кислоте ( XI), давно уже полученной Наметкиным и Хухриковой при окислении азотной кислотой камфенилана. Двухосновные кислоты легко реагируют по обеим карбоксильным группам. Двухосновные кислоты значительно более сильные, чем соответствующие оцноосновные, что связано с взаимным влиянием карбоксильных групп, и чем ближе расположены они друг к другу, тем это влияние сильнее. Поэтому наиболее сильной кислотой является щавелевая, так как карбоксильные группы в ней расположены рядом и это способствует большей степени диссоциации. Двухосновные кислоты значительно сильнее одноосновных. Двухосновные кислоты более сильные кислоты, нежели одноосновные. Здесь сказывается взаимное влияние двух карбоксилов. Сила кислот падает по мере увеличения их молекулярного веса. Двухосновные кислоты ( серная, угольная и другие) образуют. Двухосновные кислоты выделяются в виде калиевых солей, нерастворимых в спирте. Двухосновная кислота Н2А диссоциирует в две стадии. Двухосновные кислоты - кристаллические вещества, растворимые в воде; с возрастанием в их молекулах числа углеродных атомов растворимость уменьшается. Двухосновные кислоты могут образовывать соли в результате замещения водорода на металл либо в одной, либо в обеих карбоксильных группах и поэтому дают два ряда солей: кислые и средние. Двухосновные кислоты могут быть произведены от соответствующих углеводородов заменой в них двух водородов двумя карбоксильными группами. Двухосновные кислоты, дифференцированно титрующиеся по ступеням нейтрализации, определяются в смесях как с сильными, так и со слабыми кислотами. Нейтрализация сильной кислоты совпадает с первой ступенью нейтрализации двухосновной кислоты, а нейтрализация слабой - со второй. Двухосновные кислоты значительно сильнее одноосновных. Щавелевая сильнее муравьиной в 300 раз, а малоновая - в сто раз сильнее уксусной. Многоосновная кислота Многоосновные кислоты, многокислотные основания диссоциируют по ступеням. Многоосновные кислоты и основания диссоциируют ступенчато. Многоосновные кислоты диссоциируют по ступеням, поэтому соли многоосновных кислот также гидролизу-ются по ступеням. Рассмотрим для примера гидролиз карбоната натрия. Многоосновные кислоты, а также, основания двух - и более валентных металлов диссоциируют в воде ступенчато, отдавая в раствор один, два и более ионов водорода или гидроксила. Многоосновные кислоты имеют более одного замещаемого кислотного элемента и, когда не все такие элементы являются этирифициро-ванными, образуется кислый сложный эфир. Многоосновные кислоты могут образовать кислые и средние эфиры. Первые сохраняют свойства кислот. Сложные эфиры подвергаются гидролизу при нагревании с водой. Процесс гидролиза катализируется кислотами и основаниями. Многоосновные кислоты при вычислении рН можно рассматривать как одноосновные, так как они диссоциируют постепенно в несколько ступеней, причем наиболее значительно выражена диссоциация в первой ступени. Многоосновная кислота ( или смесь кислот разной силы) титруется сильной щелочью. Многоосновные кислоты, например серная, щавелевая и фосфорная, не отщепляют сразу всех ионов водорода, способных замещаться на металл. Многоосновные кислоты и многоатомные основания не сразу отщепляют все ионы водорода или гидроксила, содержащиеся в их молекулах. Электролитическая диссоциация их протекает ступенчато. Многоосновные кислоты и многоатомные основания не сразу отщепляют все ионы водорода или гидроксила, содержащиеся в их молекулах. Электролитическая диссоциация их протекает ступенчато. Многоосновные кислоты диссоциируют по ступеням, а значит, такие кислоты будут иметь по нескольку констант диссоциации - для каждой ступени свою. Многоосновные кислоты, а также основания двух - и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Многоосновные кислоты и многоатомные основания не сразу отщепляют все ионы водорода или гидроксила, содержащиеся в их молекулах. Электролитическая диссоциация их протекает ступенчато.
Поиск по сайту: |

 (упрощённая запись)
(упрощённая запись)