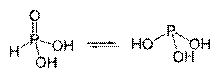|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Свойства и классификация неорганических кислотСтр 1 из 2Следующая ⇒
Министерство образования Пензенской области Государственное автономное образовательное учреждение Начального профессионально образование Профессионально училище №16 р.п. Шемышейка (ГАОУ НПО ПУ№16 р.п. Шемышейка)
Реферат на тему: «Органические и неорганические кислоты»
Выполнил: уч-ся гр.32-ГЭС Клычков Д.А. Проверила: пр-ль химии Шилова Н.Н
2013г.
Содержание
1. Классификация кислот. Химические свойства.
2. Неорганические кислоты
3. Органические кислоты
4. Одноосновные кислоты
5. Двухосновные кислоты
6. Многоосновные кислоты
7. Кислородосодержащие кислоты
8. Бескислородные кислоты
Список литературы
Классификация кислот. Химические свойства. Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык – среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как уксусная (содержится в столовом уксусе), яблочная, лимонная, аскорбиновая (витамин С), щавелевая и некоторые другие (эти кислоты содержатся в растениях) знакомы вам именно своим кислым вкусом. В этом параграфе мы рассмотрим только важнейшие неорганические кислоты, то есть такие, которые не синтезируются живыми организмами, но играют большую роль в химии и химической промышленности. Все кислоты, независимо от их происхождения, объединяет общее свойство – они содержат реакционноспособные атомы водорода. В связи с этим кислотам можно дать следующее определение: Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов.
Свойства и классификация неорганических кислот Большинство неорганических кислот при обычных условиях существуют в жидком состоянии, некоторые – в твёрдом состоянии (ортофосфорная, борная, вольфрамовая, поликремниевые (гидраты SiO2) и др.). Кислотами также являются водные растворы некоторых газообразных соединений (галогеноводородов, сероводорода H2S, диоксида азота NO2, диоксида углерода CO2 и др.). Некоторые кислоты (например, угольную Н2СО3, сернистую Н2SO3, хлорноватистую HClO и др.) невозможно выделить в виде индивидуальных соединений, они существуют только в растворе. По химическому составу различают бескислородные кислоты (HCl, H2S, HF, HCN) и кислородсодержащие (оксокислоты)(H2SO4, H3PO4). Состав бескислородных кислот можно описать формулой: HnХ, где Х — химический элемент образующий кислоту (галоген, халькоген) или бескислородный радикал: например, бромоводородная HBr, циановодородная HCN, азидоводороднаяHN3 кислоты. В свою очередь, все кислородсодержащие кислоты имеют состав, который можно выразить формулой: НnXОm, где X — химический элемент, образующий кислоту.
Таутомерные формы родановодородной кислоты
Таутомерные формы фосфористой кислоты Атомы водорода в кислородсодержащих кислотах чаще всего связаны с кислородом полярной ковалентной связью. Известны кислоты с несколькими (чаще двумя) таутомерными или изомерными формами, которые различаются положением атома водорода: Отдельные классы неорганических кислот образуют соединения, в которых атомы кислотообразующего элемента образуют молекулярные гомо- и гетерогенные цепные структуры. Изополикислоты — это кислоты, в которых атомы кислотообразующего элемента связаны через атом кислорода (кислородный мостик). Примерами выступают полисерные H2S2O7 и H2S3O10 и полихромовые кислоты H2Cr2O7 и H2Cr3O10. Кислоты с несколькими атомами разных кислотообразующих элементов, соединенных через атом кислорода, называются гетерополикислотами. Существуют кислоты, молекулярная структура которых образована цепочкой одинаковых кислотообразующих атомов, например в политионовых кислотах H2SnO6 или всульфанах H2Sn, где n≥2.Отдельно выделяют пероксокислоты — кислоты, содержащие пероксогруппы [–O–O–], например пероксомоносерная H2SO5 и пероксодисерная H2S2O8кислоты. Тиокислотами называют кислоты, содержащие вместо атомов кислорода атомы серы, например тиосерная кислота H2SO3S. Существуют и комплексные кислоты, например: H2[SiF6], H[AuCl4], H4[Fe(CN)6] и др.
Поиск по сайту: |