 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ЛАБОРАТОРНАЯ РАБОТА № 6
ИОННОБМЕННЫЙ СПОСОБ ОЧИСТКИ ВОДЫ
1Общие сведения Химическая промышленность использует воду в огромных количествах и для самых разнообразных целей. Перед использованием природная вода из водоемов подвергается очистке от различных примесей: взвешенных частиц (песок , глина), растворенных газов (кислорода, диоксида углерода, окислов азота) и солей (сульфатов, хлоридов, бикарбонатов кальция, магния, натрия, калия и др.). Промышленные водные стоки могут содержать вредные примеси, от которых вода должна быть очищена перед сбрасыванием в водоем. Ионнообменные способы используются для очистки воды от растворенных веществ, которые в воде могут диссоциировать на ионы (кислоты, щелочи, соли). Ионообменный способ очистки воды основан на фильтровании воды с диссоциированными примесями через слой зернистых ионообменников , способных обменивать свои ионы на ионы, содержащиеся в воде. Катиониты - сложные комплексы (сульфоуголь, высокомолекулярные смолы) с подвижными ионами Н Аниониты – высокомолекулярные вещества, содержащие анионы
Важными определениями очистки воды являются ее умягчение и обессоливание. Умягчение воды заключается в выделении из нее ионов Сa и др . придают воде жесткость. Необходимость умягчения воды связана с выпадением в определенных условиях ионов жесткости в виде трудно растворимых осадков на обогреваемых поверхностях аппаратов (теплообменники, рубашки реакторов, паровые котлы). Эти осадки уменьшают свободное сечение трубопроводов, снижают коэффициент теплопередачи, а в паровых котлах, обогреваемым открытым пламенем, могут привести к прожогу стенок с последующим взрывом.
Стр 11
Различают временную (карбонатную), постоянную (карбонатную) общую жесткость. Временная жесткость обусловлена присутствием в воде карбонатов калия и магния Сa 2Mg Постоянная жесткость обусловлена содержанием в воде других (кроме карбонатных) водорастворимых солей кальция и магния CaCl Общая жесткость- сумма временной и постоянной жесткостей. Жесткость воды выражается суммой миллиграмм-эквивалентов ионов Ca Для умягчения воды используют H При этом протекают следующие реакции:
Ca(HCO
MgCl
CaSO
MgCl
Аналогично из воды могут быть извлечены ионы других металлов. С течением времени в связи с обратимостью реакций ионообмена ионы жесткости начинают проскакивать через катионитный фильтр, и жесткость умягчаемой воды постепенно вырастает. При достижении предельно допустимой жесткости Ж Процесс умягчения протекают, и катионит подвергают регенерации. Регенерация в зависимости от требуемого иона осуществляется 2-5 % -ными растворами щелочей, кислот или солей:
Са Мg Ca
Выделившиеся при регенерации вещества вымывают из катионита умягченной или обессоленной водой.
Стр12
Способность катионита обменивать ионы оценивается обменной емкостью катионита. Рабочая обменная емкость катионита Е
Е
Где Ж - жесткость исходной воды, мг-экв/дм Ж
Обессоливание воды заключается в выведении из нее всех катионов и анионов растворенных солей. Обессоливание воды методом ионного обмена заключается в последовательном пропускании воды через H
При этом на катионе обмениваются все катионы солей на ион Н Na
[Aн] Выделившиеся при регенерации анионита кислоты вымывают обессоленной водой. Способность анионита обменивать анионы оценивается обменной емкостью анионита . Например, рабочая обменная емкость анионита Е Е
Где К- концентрация НСl в воде, поступаемой на К
Cтр 13
Цель работы
1. Экспериментально изучить процессы умягчения и обеспечения воды на ионообменниках. 2. Определить рабочие обменные емкости катионита и анионита.
Поиск по сайту: |
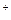 , Na
, Na  , способные их обменивать на катионы, содержащиеся в воде . Соответственно катионы обозначаются Н
, способные их обменивать на катионы, содержащиеся в воде . Соответственно катионы обозначаются Н  [кат] , Na
[кат] , Na  , К
, К 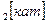 , NН
, NН  .
. , способные их обменивать на ионы, содержащиеся в воде. Аниониты - высокомолекулярные вещества, содержащие анионы
, способные их обменивать на ионы, содержащиеся в воде. Аниониты - высокомолекулярные вещества, содержащие анионы ,. способные их обменивать на ионы, содержащиеся в воде. Аниониты обозначаются
,. способные их обменивать на ионы, содержащиеся в воде. Аниониты обозначаются  ,
, 
 , Mg
, Mg  .Cl
.Cl  , SO
, SO 
 , Mg
, Mg  ,которые при нагревании переходят в нерастворимые карбонаты
,которые при нагревании переходят в нерастворимые карбонаты

 . и пр. Эти соли остаются в воде после кипячения используются другие методы.
. и пр. Эти соли остаются в воде после кипячения используются другие методы. .и Mg
.и Mg  (литре) воды. Один миллиграмм-эквивалент соответствует 20,04 мг ионов Ca
(литре) воды. Один миллиграмм-эквивалент соответствует 20,04 мг ионов Ca  или Na
или Na  )
)  Ca
Ca  Mg
Mg 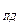 = 0,4 -0,5 мг-экв/дм
= 0,4 -0,5 мг-экв/дм  Na
Na  + Ca (OH)
+ Ca (OH)  H
H 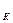 , мг-экв /дм
, мг-экв /дм 
 ;
; - объем катионита, дм
- объем катионита, дм  ,Ca, Mg(HCO
,Ca, Mg(HCO  +2НСl+
+2НСl+ 

 , Cl
, Cl  моль/дм
моль/дм  (1.2)
(1.2) - объем анионита, дм
- объем анионита, дм 