|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Лечение острой левожелудочковой недостаточности и кардиогенного шока
Лечение больных ИМ, осложненным острой левожелудочковой недостаточностью, должно проводиться под постоянным контролем клинических, лабораторных, электрокардиографических данных, а также показателей гемодинамики. Интенсивная терапия этих больных требует проведения максимально полного гемодинамического мониторинга с определением ДЗЛА (или диастолического давления в легочной артерии), ЦВД, СИ, АД и ФВ. С этой целью может быть использована катетеризация правых отделов сердца катетером Свана–Ганца. При стойкой артериальной гипотензии (кардиогенный шок) показана установка артериального катетера. При отсутствии такой возможности приходится ориентироваться на: · клинические данные — тяжесть состояния больного, ЧДД, ЧСС, аускультативные признаки застоя крови в легких и проявления периферической гипоперфузии; · величину системного АД; · значения ЦВД; · результаты динамического эхокардиографического исследования; · значения почасового диуреза Лечение отека легких Лечение больных отеком легких должно быть направлено на коррекцию ДЗЛА (диастолического давления в легочной артерии), признаков застоя крови в малом круге кровообращения и нормализацию сердечного индекса. Выбор тактики лечения в каждом конкретном случае зависит, прежде всего, от гемодинамического типа острой левожелудочковой недостаточности Застойный тип гемодинамики. Если у больного с острой левожелудочковой недостаточностью систолическое АД нормально или умеренно снижено (выше 100–110 мм рт. ст.), диастолическое давление в легочной артерии (или ДЗЛА) составляет 18–20 мм рт. ст. (норма 8–12 мм рт. ст.), наблюдается удушье и влажные хрипы в легких, а СИ и ЦВД практически не изменены и отсутствуют признаки периферической гипоперфузии, показано применение следующих лечебных мероприятий. Диуретики. Обычно используют петлевые диуретики. Фуросемид (лазикс) вводят внутривенно в дозе 20–80 мг однократно или несколько раз в день. При необходимости разовые дозы введения препарата могут быть увеличены (максимальная суточная доза — 2000 мг). Фуросемид, обладающий мощным диуретическим действием, уменьшает ОЦК, АД, величину постнагрузки и преднагрузки, а также ДЗЛА, что сопровождается уменьшением или исчезновением одышки и влажных хрипов в легких. Характерно, что гемодинамическая разгрузка малого круга кровообращения начинается уже через несколько минут после введения препарата, т.е. задолго до начала его диуретического действия (около 30 мин). Внутривенное введение фуросемида целесообразно продолжать еще в течение 2–3 дней, а затем при необходимости перейти на пероральный прием препарата по 40–80 мг в сутки (однократно). При лечении фуросемидом возможно нежелательное снижение систолического АД ниже 90 мм рт. ст. и уменьшение СИ, что сопровождается уменьшением коронарной перфузии и расширением зоны некроза, а также развитием гипокалиемии (угроза появления аритмий). Поэтому лечение требует постоянного гемодинамического контроля за эффектами препарата. Вазодилататоры(нитроглицерин, натрия нитропруссид и др.) являются основными лекарственными средствами, которые используют для лечения отека легких у больных ИМ (при условии систолического АД не ниже 90 мм рт. ст.). Нитроглицерин обладает выраженными венодилатирующими свойствами, что позволяет значительно и быстро уменьшить приток крови к сердцу, величину преднагрузки и, соответственно, давление наполнения ЛЖ и признаки застоя в малом круге кровообращения. Кроме того, нитроглицерин, снижая тонус артериолярных сосудов (в том числе коронарных), способствует уменьшению ОПСС, величины постнагрузки на ЛЖ и увеличению коронарной перфузии. Натрия нитропруссид в большей степени, чем нитроглицерин, оказывает влияние на артериолы. Поэтому у больных ИМ, осложненном отеком легких с сопутствующей АГ, более целесообразно назначение натрия нитропруссида. Нитроглицерин (1% спиртовой раствор) вводят внутривенно капельно на 0,9% растворе натрия хлорида, начиная с 5–10 мг в мин с постепенным увеличением скорости каждые 10 мин. Инфузию нитроглицерина прекращают:
В дальнейшем в течение 24–72 ч проводят “поддерживающие” инфузии раствора нитроглицерина, обеспечивающие оптимальный уровень давления заклинивая (ДЗЛА), и затем переходят к пероральному приему нитратов в обычных дозах (изосорбида динитрат или изосорбида мононитрат). У больных с АГ и отеком легких предпочтительны внутривенные инфузии натрия нитропруссида, что обеспечивает не только снижение ДЗЛА, но и системного АД. Морфин подавляет избыточную активность дыхательного центра, устраняя тем самым тахипноэ. Кроме того, морфин обладает периферическим вазодилатирующим действием, способствующим уменьшению венозного возврата крови к сердцу, снижению ДЗЛА и величины преднагрузки. Морфин вводят внутривенно струйно в дозе 2–5 мг. Оксигенотерапия показана практически во всех случаях отека легких. Использование ингаляций увлажняющего кислорода через носовые катетеры или подача 100% кислорода с помощью маски со скоростью 6–12 л/мин позволяет не только уменьшить признаки гипоксии ЦНС и метаболического ацидоза, но и улучшить механические свойства самих легких, поскольку они страдают от гипоксии не меньше, чем другие органы. Повышение концентрации кислорода приводит к снижению афферентной импульсации с синокаротидных и других хеморецепторов и уменьшению тахипноэ. При альвеолярном отеке легких необходимо использование пеногасителей, в частности, паров спирта. Наличие выраженных клинических признаков отека легких, соответствующих III классу по классификации Т. Killip и J. Kimball, и быстрое прогрессирование дыхательной недостаточности, сопровождающееся спутанным сознанием, выраженным цианозом или землистым цветом кожи, изменением величины зрачков, активным участием в дыхании вспомогательной мускулатуры на фоне выраженной одышки, являются прямым показанием для интубации трахеи и проведения аппаратной искусственной вентиляции легких (ИВЛ) с положительным давлением в конце выдоха. Более высокое внутриальвеолярное и внутрибронхиальное давление, создаваемое ИВЛ, способствует увеличению растяжимости легких, расправлению ателектазов и улучшению вентиляционно-перфузионных соотношений и газообмена. Кроме того, повышенное внутригрудное давление нарушает венозный возврат крови к сердцу и способствует снижению ДЗЛА и разгрузке малого круга кровообращения. Методика ИВЛ более подробно описана в последующих главах руководства. Гипокинетический тип гемодинамики. Если у больного с клинической картиной отека легких имеет место не только значительное повышение ДЗЛА (выше 20 мм рт. ст.) и ЦВД, но и снижение СИ (меньше 2,0 л/мин/м2) и систолического АД, речь идет о выраженном нарушении насосной функции ЛЖ, которое нередко сочетается с признаками периферической гипоперфузии (олигурия, похолодание конечностей, артериальная гипотония), т.е. с начальными проявлениями кардиогенного шока. В этих случаях активное воздействие на ДЗЛА и застой крови в легких с использованием вазодилататоров должно сочетаться с обязательным применением препаратов, обладающих инотропным действием. Добутамин (добутрекс) является селективным стимулятором β1-адренергических рецепторов, обладающим выраженным инотропным действием. Он мало влияет на ЧСС и несколько снижает ОПСС и легочное сосудистое сопротивление, а также давление наполнения ЛЖ (или ДЗЛА). При этом системное АД практически не изменяется. Добутамин вводят внутривенно капельно со скоростью 2,5–10 мкг/кг/мин. Допамин является агонистом допаминовых рецепторов и в относительно высоких дозах вызывает возбуждение α- и β-адренорецепторов, усиливая выделение норадреналина в синаптическую щель. Допамин увеличивает сократительную способность миокарда, сердечный выброс и оказывает заметное хронотропное действие на сердце, увеличивая ЧСС. В отличие от добутамина, допамин оказывает влияние на сосудистый тонус (α-адренорецепторы), повышает ОПСС и АД. Допамин применяют при тяжелой левожелудочковой недостаточности, сочетающейся с артериальной гипотензией. Препарат вводится внутривенно капельно со скоростью 5–10 мкг/кг/мин. При отсутствии эффекта возможна одновременная инфузия допамина и добутамина в максимально переносимых дозировках. Следует помнить, что применение любых симпатомиметиков, обладающих мощным кардиостимулирующим действием, сопровождается увеличением потребности миокарда в кислороде. Поэтому при их передозировке у больных ИМ может усугубляться ишемия миокарда. В результате еще больше снижается сердечный выброс, повышается ДЗЛА и увеличиваются признаки застоя в легких. В связи с этим введение этих лекарственных средств больным ИМ должно проводиться под строгим контролем гемодинамических показателей. Норадреналин — адреномиметик, действующий преимущественно на α1- и α2-адренорецепторы и, в меньшей степени, на β1-адренорецепторы. Норадреналин обладает наиболее выраженным прессорным эффектом, существенно повышает ОПСС и системное АД, увеличивая риск возникновения аритмий. Эти свойства норадреналина делают его малопригодным для лечения острой левожелудочковой недостаточности у больных ИМ, поскольку при его применении может усугубляться ишемия миокарда и возрастает риск возникновения аритмий. Монотерапия норадреналином рассматривается в настоящее время как вынужденная мера при отсутствии других симпатомиметиков Применение в качестве инотропного ЛС дигоксина не показано у больных ИМ, поскольку часто сопровождается возникновением гликозидной интоксикации. При стабилизации состояния больных и нормализации АД переходят к инфузии вазодилататоров. Нередко введение нитроглицерина и симпатомиметиков осуществляют параллельно. Для коррекции микроциркуляторных нарушений и предотвращения дальнейшего тромбозирования коронарных сосудов у больных с тяжелыми проявлениями отека легких особенно целесообразно применение гепаринов и антиагрегантов (клопидогрель, блокаторы IIb/IIIа рецепторов тромбоцитов, аспирина и др.). Лечение кардиогенного шока Начиная терапию кардиогенного шока, следует, прежде всего, убедиться, с какой формой этого осложнения имеет дело врач, поскольку на начальном этапе его формирования несколько патологических состояний, развивающихся у больных ИМ, имеют сходную клиническую симптоматику: снижение АД, сердечного индекса (СИ), гипоперфузия периферических органов и тканей и т.п. К числу таких патологических состояний относятся: 1. Рефлекторный (болевой) шок (коллапс). 2. Аритмический шок. 3. Гиповолемия, вызванная обезвоживанием организма и уменьшением венозного притока крови к сердцу (неукротимая рвота, передозировка диуретиков, вазодилататоров и др.). 4. Истинный кардиогенный шок и др. Рефлекторный шок (коллапс) обычно легко поддается лечению препаратами, купирующими болевой ангинозный приступ. Изредка требуется введение симпатомиметических аминов, которые быстро нормализуют системное АД. Аритмический шок. Клинические проявления аритмического шока, вызванного падением сердечного выброса в результате возникновения тяжелых нарушений сердечного ритма и проводимости (пароксизмальная ЖТ, фибрилляция желудочков, АВ-блокады II–III степени и др.), также сравнительно быстро купируются, если удается восстановить сердечный ритм с помощью электроимпульсной терапии (ЭИТ), ЭКС или антиаритмических средств. Гиповолемический шок. Лечение больных с гиповолемическим шоком имеет некоторые особенности. По понятным причинам, у этих больных, по крайней мере, на начальном этапе лечения не должны использоваться вазодилататоры (нитроглицерин и натрия нитропруссид), мочегонные средства, наркотические анальгетики. Введение симпатомиметиков (добутамин, допамин, норадреналин) также противопоказано больным с выраженной гиповолемией. Лечение больных с гиповолемическим шоком должно быть направлено, прежде всего, на увеличение венозного возврата к сердцу, достижение оптимального уровня ДЗЛА (15–18 мм рт. ст.) и восстановление насосной функции ЛЖ преимущественно за счет увеличение преднагрузки и включения механизма Старлинга. С этой целью больным с гиповолемией назначают инфузии 0,9% раствора натрия хлорида или низкомолекулярных декстранов, например, реополиглюкина или декстрана 40. Последние не только эффективно возмещают внутрисосудистый объем крови, но и улучшают реологические свойства крови и микроциркуляцию. Лечение проводят под контролем ЦВД, ДЗЛА, СИ и АД. Введение жидкости прекращают при повышении систолического АД до 100 мм рт. ст. и выше и/или при повышении ДЗЛА (или диастолического давления в легочной артерии) до 18–20 мм рт. ст., а также при появлении одышки и влажных хрипов в легких и повышении ЦВД.
После прекращения введения жидкости вновь оценивают все гемодинамические показатели и при необходимости переходят к лечению острой левожелудочковой недостаточности так, как это описано выше для застойного и гипокинетического вариантов гемодинамических изменений. При этом введение симпатомиметиков, вазодилататоров, наркотических анальгетиков проводят с особой осторожностью под гемодинамическим контролем. Истинный кардиогенный шок. Несмотря на большие успехи, достигнутые в последние годы в ведении больных ИМ, лечение истинного кардиогенного шока до сих пор представляет чрезвычайно сложную задачу. Летальность при этом осложнении ИМ до сих пор достигает 65–90%. Смертность от кардиогенного шока удается несколько снизить только при своевременном кардиохирургическом вмешательстве, направленном на восстановление коронарного кровообращения в инфарктсвязанной КА (ЧТКА или АКШ). Летальность при этом снижается до 30–40%. Поэтому в подавляющем большинстве случаев цель симптоматического лечения кардиогенного шока, осуществляемого в кардиореанимационном отделении, — временно стабилизировать гемодинамику и обеспечить проведение экстренных хирургических вмешательств, направленных на восстановление коронарного кровотока (А.Л. Сыркин). В большинстве случаев лечение кардиогенного шока включает (Ф.И. Плешков): 1.Общие мероприятия:
2. Внутривенное введение жидкости (при отсутствии противопоказаний). 3. Применение периферических вазодилататоров. 4. Применение инотропных средств. 5. Применение ЭИТ или ЭКС (при возникновении сердечных аритмий или нарушений проводимости). 6. Внутриаортальная баллонная контрпульсация. 7. Хирургическое лечение:
Многие из перечисленных лечебных мероприятий были описаны в предыдущих разделах. Здесь мы рассмотрим лишь общую тактику ведения больных с истинным кардиогенным шоком в зависимости от результатов гемодинамического мониторинга. После катетеризации правых отделов сердца и установки плавающего катетера Свана–Ганца в легочной артерии оценивают показатели центральной гемодинамики, а также клинические данные. 1. Если значения СИ ниже 2,2 л/мин/м2, величина диастолического давления в легочной артерии (или ДЗЛА) меньше 15 мм рт. ст., а рентгенологические и клинические признаки застоя крови в легких отсутствуют, лечение целесообразно начать с внутривенного введения 0,9% раствора натрия хлорида или реополиглюкина. Введение жидкости продолжают до тех пор, пока ДЗЛА не достигнет 18–20 мм рт. ст., а ЦВД — 15–20 мм рт. ст. При этих значения ДЗЛА и ЦВД дальнейшее введение жидкости противопоказано 2. Если диастолическое давление в легочной артерии (или ДЗЛА) изначально находится в пределах 18–20 мм рт. ст. и имеются признаки умеренного застоя крови в легких (влажные хрипы), лечение начинают с симпатомиметиков — добутамина или/и допамина (см. выше). 3. Если ДЗЛА превышает 20 мм рт. ст. и имеются признаки легочного застоя и проявления отека легких, лечение инотропными средствами (добутамин или/и допамин) обязательно сочетают с внутривенным капельным введением раствора нитроглицерина или натрия нитропруссида (см. выше). Кроме того, проводится коррекция микроциркуляторных нарушений (гепарин, трентал, аспирин в обычных дозах), а также метаболического ацидоза и нарушений электролитного баланса. 4. При отсутствии эффекта и сохранении артериальной гипотонии показано проведение внутриаортальной баллонной контрпульсации. Принцип метода заключается в следующем. Используя артериальный доступ, в грудной отдел аорты вводят баллон, соединенный со специальным устройством, которое позволяет синхронизировать раздувание баллона с фазами сердечной деятельности: в систолу он спадается (рис. 6.55, а), а в диастолу — раздувается (рис. 6.55, б). Раздувание внутриаортального баллона в диастолу сопровождается увеличением диастолического давления в аорте. В результате возрастает перфузионное давление в коронарных сосудах, кровоток по которым осуществляется в диастолу, и увеличивается кровоснабжение, по крайней мере, неповрежденного (интактного) миокарда.
Во время систолы внутриаортальный баллон спадается, что приводит к снижению сопротивления систолическому изгнанию крови из ЛЖ и уменьшению постнагрузки и, соответственно, потребности миокарда в кислороде. Во время проведения внутриаортальной баллонной контрпульсации сердечный выброс увеличивается в среднем на 40%, а КДД в ЛЖ снижается примерно на 20%, что нередко значительно улучшает перфузию периферических органов и тканей и состояние больного. Однако после прекращения процедуры контрпульсации этот эффект полностью исчезает. Поэтому внутриаортальная контрпульсация у больных ИМ и кардиогенным шоком используется, в основном, для того, чтобы выиграть время для проведения КАГ и подготовки к экстренному хирургическому вмешательству с целью ранней реваскуляризации ИМ (D. Alpert, G. Frensis, 1994). Экстренная чрескожная транслюминальная ангиопластика и аорто-коронарное шунтирование — наиболее распространенные оперативные вмешательства, направленные на реваскуляризацию миокарда у больных ИМ. Показаниями к экстренным хирургическим вмешательствам при ИМ являются:
Разнообразные нарушения сердечного ритма и проводимости являются самыми частыми осложнениями ИМ. В первые часы и дни от начала заболевания они выявляются при мониторном ЭКГ-наблюдении у 90–95% больных ИМ. Некоторые из аритмий могут быть причиной тяжелых расстройств гемодинамики и летальных исходов. Причем 2/3 случаев аритмической смерти приходятся на первые 6 ч после развития ИМ (В.Л. Дощицин, 1993). По своему прогностическому значению все аритмии, встречающиеся при ИМ, делят на 4 группы (А.Л. Сыркин): 1. Жизнеопасные аритмии — аритмии, являющиеся непосредственными причинами смерти:
2. Аритмии, усугубляющие сердечную недостаточность и гипоперфузию жизненно важных органов:
3. Аритмии — предвестники жизнеопасных нарушений сердечного ритма:
4. Аритмии — “спутники” острого ИМ:
Все жизнеопасные аритмии (1-я группа), безусловно, требуют проведения экстренных лечебных мероприятий, направленных на их купирование. В то же время тактика ведения больных с аритмиями, относящимися ко 2-й и 3-й группам, должна быть чрезвычайно взвешенной и учитывать не только индивидуальный характер и тяжесть аритмий, их реальное воздействие на гемодинамику и перфузию миокарда, но и возможность самостоятельного купирования аритмий при лечении основного заболевания, а также возможные неблагоприятные последствия самой противоаритмической терапии. Наконец, нарушения ритма и проводимости, относящиеся к IV группе, как правило, не требуют специального активного противоаритмического лечения. Патогенез Электрофизиологические механизмы возникновения аритмий у больных острым ИМ в целом соответствуют таковым, описанным в главе 3. К ним относятся:
Основными факторами, способствующими формированию этих и некоторых других механизмов аритмий, являются локальное очаговое замедление и фрагментация волны возбуждения, распространяющейся в электрически неоднородной среде, отдельные участки которой отличаются различной длительностью ПД и рефрактерных периодов, скоростью спонтанной диастолической деполяризации и т.п. Большое значение имеет также механическое растяжение волокон миокарда в результате дилатации камер сердца, наличие гипертрофии сердечной мышцы, а также нарушения нейрогуморальной регуляции сердечного ритма, электролитного обмена, кислотно-основного состояния, гиперкатехоламинемия и т.п. Синусовые нарушения ритма Синусовая брадикардия — урежение сердечных сокращений (< 60 в мин) вследствие снижения автоматизма СА-узла. Синусовая брадикардия возникает главным образом при инфарктах заднедиафрагмальной области, поскольку именно в этих случаях происходит тромбоз ПКА, участвующей в кровоснабжении СА-узла. Нередко синусовая брадикардия у больных с нижним ИМ может явиться следствием ваготонической реакции по типу рефлекса Бецольда–Яриша, так как в заднедиафрагмальной (нижней) стенке ЛЖ богато представлены афферентные рецепторы n. vagi. В этих случаях синусовая брадикардия часто сочетается с выраженной артериальной гипотонией, болями в эпигастральной области (в первые часы ИМ), тошнотой и рвотой. Для купирования брадикардии внутривенно струйно вводят 0,5–1,0 мг атропина сульфата. Если ЧСС не увеличивается, через несколько минут атропин вводят повторно в тех же дозах. Если эффект все же отсутствует и ЧСС не превышает 40–50 ударов в мин, сохраняется низкое АД, падает СИ и появляются признаки периферической гипоперфузии тканей и органов, показана временная ЭКС (см. главу 3). Синусовая брадикардия, не сопровождающаяся ухудшением состояния больного, специального лечения не требует. Синусовая тахикардия — увеличение ЧСС > 100 ударов в мин встречается у 1/4 - 1/3 больных ИМ, чаще передней локализации. Наиболее частыми причинами синусовой тахикардии у больных ИМ являются:
Хотя синусовая тахикардия ведет к увеличению потребности миокарда в кислороде и в условиях острого тромбоза КА может способствовать расширению зоны некроза, в большинстве случаев она не требует специального лечения, поскольку при устранении указанных причин аритмии, как правило, купируется и сама синусовая тахикардия. В более редких случаях, когда ЧСС превышает 110–120 ударов в мин, показано дополнительное назначение малых доз β-адреноблокаторов (при отсутствии противопоказаний к их приему). Наджелудочковые нарушения ритма Наджелудочковая экстрасистолия (предсердная, узловая) регистрируется у 20–25% больных ИМ. В большинстве случаев ее появление не требует специального противоаритмического лечения. Фибрилляция предсердий встречается примерно у 10–15% больных ИМ, в том числе у пациентов с ИМ правого желудочка. Ее возникновение связано, в первую очередь, с растяжением стенок предсердия при повышении в нем давления (например, при острой сердечной недостаточности) или с распространением ишемического повреждения на миокард предсердий. Возникновение тахисистолической формы фибрилляции предсердий может способствовать нарушению перфузии миокарда и усугублению признаков сердечной недостаточности. Тем не менее решение вопроса о необходимости экстренного купирования пароксизма мерцательной аритмии у больных ИМ должно быть чрезвычайно взвешенным. При нормосистолической или брадисистолической форме мерцательной аритмии специального лечения не требуется, так как у многих больных ИМ через несколько дней синусовый ритм восстанавливается самостоятельно. Тахисистолическая форма фибрилляции предсердий при плохой ее переносимости больным и/или при нарастании признаков сердечной недостаточности, как правило, требует купирования пароксизма. С этой целью лучше использовать амиодарон (300–450 мг внутривенно капельно) или ЭИТ (см. главу 3). Предварительно необходимо оценить, насколько эффективным может оказаться такое купирование пароксизма мерцательной аритмии и насколько высока при этом вероятность рецидива фибрилляции предсердий.
Пароксизмальная наджелудочковая тахикардия (предсердная или из АВ-соединения) характеризуется очень высоким ритмом желудочков (до 120–250 в мин), что, несомненно, оказывает выраженное отрицательное влияние на функциональное состояние ЛЖ и перфузию миокарда. Купирование пароксизма наджелудочковой тахикардии целесообразно начинать с быстрого болюсного внутривенного введения 6–12 мг аденозина (АТФ). При отсутствии эффекта введение АТФ повторяют или вводят новокаинамид, аймалин или другой противоаритмический препарат по схемам, описанным в главе 3.
Желудочковые нарушения ритма Желудочковую экстрасистолию (ЖЭ) обнаруживают почти у всех больных ИМ. Сами по себе ЖЭ не оказывают сколько-нибудь существенного влияния на гемодинамику и перфузию миокарда. Однако некоторые из них свидетельствуют о наличии выраженной негомогенности миокарда ЛЖ, которая может являться причиной других, жизнеопасных, аритмий: желудочковой тахикардии (ЖТ) и фибрилляции желудочков (ФЖ). К прогностически неблагоприятным ЖЭ, которые ассоциируются с высоким риском возникновения ЖТ и ФЖ, традиционно относят:
Эти виды ЖЭ расцениваются как своеобразные предвестники ЖТ и ФЖ. В то же время в последние годы было убедительно показано, что и другие виды ЖЭ (например, поздние ЖЭ) нередко предшествуют ФЖ. С другой стороны, перечисленные виды “угрожающих” ЖЭ (в том числе ранние, политопные, парные и даже групповые ЖЭ) иногда выявляются у молодых здоровых лиц. Это свидетельствует о том, что вопрос о прогностическом значении желудочковой экстрасистолии у больных ИМ еще далек от своего разрешения. По всей вероятности, появление любой желудочковой эктопической активности у больного ИМ, особенно в первые часы заболевания, должно служить поводом для особой настороженности врача в отношении возможности ФЖ. В то же время ЖЭ не является поводом для немедленного профилактического назначения антиаритмических препаратов (например, лидокаина), как это считалось совсем недавно, поскольку неоправданное применение этих препаратов у больных ИМ повышает риск развития асистолии желудочков и внезапной сердечной смерти (R. Campbell, 1975, В.А. Люсов, 2000). С профилактической целью могут использоваться β-адреноблокаторы (при отсутствии противопоказаний для их применения). Желудочковая тахикардия. Короткие эпизоды (“пробежки”) желудочковой тахикардии (ЖТ), состоящие из нескольких следующих друг за другом ЖЭ, не оказывают влияния на гемодинамику, уровень АД и коронарный кровоток и нередко остаются незамеченными больными. Как правило, они выявляются при мониторном наблюдении ЭКГ. Так же как и нечастые ЖЭ, они не требуют специального антиаритмического лечения, за исключением возможного назначения β-адреноблокаторов. Стойкая ЖТ с частотой ритма 160–220 в мин может приводить к расширению зоны некроза и ишемии миокарда, снижению насосной функции сердца и периферической гипоперфузии. Неблагоприятными исходами такой формы ЖТ являются:
При стойкой ЖТ необходимо экстренное купирование пароксизма. Если клиническая ситуация позволяет, можно использовать следующую последовательность лечебных мероприятий: 1.Удар кулаком в грудь. Этот прием нередко позволяет прервать патологическую циркуляцию волны возбуждения. 2. Медикаментозное купирование пароксизма. Лидокаин вводят внутривенно струйно в дозе 50 мг. При отсутствии эффекта через 2 мин возможно повторное введение препарата в той же дозе. После купирования пароксизма ЖТ назначают внутривенно медленно инфузию лидокаина в дозе 100–150 мг. 3. При отсутствии эффeкта от введения лидокаина проводят электрическую кардиоверсию (см. главу 3).
Иногда приступы ЖТ можно купировать с помощью учащающей программированной электрической стимуляции сердца (см. главу 3). Фибрилляция желудочков (ФЖ) клинически характеризуется внезапной потерей сознания, отсутствием тонов сердца и артериального пульса. АД не определяется. Возникает агональное дыхание, которое вскоре прекращается совсем (клиническая смерть). Различают:
Наиболее неблагоприятной в прогностическом отношении является вторичная ФЖ.
Риск рецидивирования ФЖ и внезапной смерти у больных, перенесших успешную кардиоверсию, чрезвычайно велик. Нарушения АВ-проводимости АВ-блокада I степени не требует специального лечения, хотя при ее возникновении следует скорректировать медикаментозную терапию ИМ, отменив (или заменив) лекарственные средства, угнетающие АВ-проводимость (например, b-адреноблокаторы). АВ-бокада II степени I типа Мобитца характеризуется постепенным удлинением интервала Р–Q(R) с периодическим выпадением желудочкового комплекса QRST. Этот вид АВ-блокады обычно носит преходящий характер и сохраняется в течение первых 3-х дней от начала ИМ. Блокада вызвана обычно ишемией АВ-узла, связанной с окклюзией ПКА, и наблюдается, соответственно, при заднедиафрагмальном (нижнем) ИМ. В возникновении этого типа блокады нередко имеет значение рефлекторное повышение тонуса блуждающего нерва. Лечение включает атропин подкожно 0,5–1,0 мг или в вену — 0,3–0,5 мг 2–3 раза в сутки. Общая суточная доза не должна превышать 2,0 мл 0,1% раствора атропина. При падении АД, показателей гемодинамики или кардиогенном шоке целесообразно применение ЭКС. АВ-блокада II степени II типа Мобитца на ЭКГ представлена постоянным (нормальным или удлиненным) интервалом Р–Q(R) и периодическими выпадениями желудочкового комплекса. Этот тип блокады обусловлен, как правило, необратимым проведением возбуждения в нижней части пучка Гиса, нередко в сочетании с блокадой левой передней, левой задней или правой ветви пучка Гиса. АВ-блокада II степени II типа Мобитца при ИМ имеет весьма неблагоприятный прогноз, нередко внезапно переходит в АВ-блокаду III степени (полную). Поэтому во всех случаях АВ-блокады II степени II типа целесообразно применение временной ЭКС. АВ-блокада III степени (полная) может развиться в первые часы и дни ИМ. В целом это нарушение предсердно-желудочкового проведения имеет неблагоприятный прогноз, хотя многое зависит от локализации нарушенного проведения и характера замещающего ритма. При проксимальной АВ-блокаде III степени эктопический водитель ритма располагается обычно в АВ-соединении ниже места блокады. На ЭКГ при этом регистрируют полное разобщение предсердного и желудочкового ритмов, ЧСС превышает 40 ударов в мин, а желудочковые комплексы QRS не изменены (“узкие”). Такая блокада часто сочетается с заднедиафрагмальным (нижним) ИМ и высоким тонусом блуждающего нерва. В большинстве случаев она исчезает через несколько дней от начала заболевания, мало осложняя прогноз ИМ. При дистальной (трифасцикулярной) форме АВ-блокады III степени нарушение проведения локализуется ниже АВ-соединения, и на ЭКГ фиксируется редкий (< 40 в мин) идиовентрикулярный ритм с широкими деформированными комплексами QRS. Дистальный тип блокады чаще развивается при обширном переднем ИМ с поражением МЖП и имеет очень неблагоприятный прогноз: летальность может достигать 80%, если не предпринимаются соответствующие лечебные мероприятия. Блокада способствует резкому снижению сердечного выброса и развитию отека легких и кардиогенного шока.
Аневризма левого желудочка — это локальное ограниченное выбухание истонченного и не сокращающегося участка стенки ЛЖ, состоящего из некротизированной или рубцовой ткани. Аневризма развивается при обширных трансмуральных ИМ, преимущественно в области верхушки и передней стенки ЛЖ. Аневризма ПЖ встречается крайне редко. Ограниченное выпячивание некротизированной стенки желудочка во время его систолы (дискинезия) наблюдается в остром периоде заболевания практически у всех больных ИМ с зубцом Q. Это так называемая динамическая аневризма ЛЖ, которая хорошо выявляется при эхокардиографическом исследовании или вентрикулографии, являясь одним из важнейших признаков трансмурального ИМ. Со временем в этой области происходит формирование полноценного плотного рубца, локальное систолическое выпячивание стенки желудочка (дискинезия) у большинства больных исчезает, и в этой зоне остаются лишь эхокардиографические признаки локальной акинезии (отсутствия движения стенки желудочка). Только в 15–20% случаев трансмурального ИМ аневризма сохраняется. Основными факторами, способствующими образованию истинной аневризмы ЛЖ, являются:
Формирование аневризмы ЛЖ может иметь ряд неблагоприятных последствий: 1. Увеличение и деформация полости ЛЖ, согласно закону Лапласа (см. главу 1), сопровождаются ростом внутримиокардиального напряжения неповрежденных участков сердечной мышцы, увеличивая тем самым общую потребность миокарда в кислороде испособствуя возрастанию признаков коронарной недостаточности. 2. При аневризме еще больше усугубляются систолическая и диастолическая дисфункции ЛЖ, снижается сердечный выброс, возрастает КДД ЛЖ и, соответственно, давление наполнения желудочка. Это повышает риск возникновения застоя крови в малом круге кровообращения и других признаков сердечной недостаточности. 3. В большинстве случаев в области аневризмы формируется пристеночный тромб, что может приводить к развитию тромбоэмболических осложнений. Наличие аневризмы способствует формированию повторного входа и патологической циркуляции волны возбуждения (macro-re-entry) с развитием жизнеопасных желудочковых нарушений ритма (пароксизмальной ЖТ и ФЖ). В целом летальность больных трансмуральным ИМ, осложненным аневризмой ЛЖ, в 4–5 раз выше, чем больных без аневризмы. Диагностика Диагностика аневризмы ЛЖ основывается на выявлении нескольких клинических и инструментальных признаков. 1. Обнаружение при пальпации сердца отчетливой локальной прекардиальной пульсациивIII–IV межреберье слева от грудины или появление ранее отсутствовавшей пульсации в области верхушечного толчка. В этом последнем случае (аневризма верхушки) часто пальпируется так называемый “двойной” верхушечный толчок, отражающий пассивное движение тонкой аневризматической стенки как во время систолы желудочка, так и в период систолы левого предсердия, что бывает хорошо видно на кривой верхушечной кардиограммы (апекскардиограммы), отражающей механическое движение верхушки сердца во время сердечного цикла (рис. 6.56). При аускультации сердца в этих случаях часто определяется пресистолический ритм галопа.
2. Отсутствие типичной динамики ЭКГ в остром, подостром и постинфарктном периодах (“застывшая” ЭКГ). На ЭКГ выявляются признаки обширного трансмурального ИМ (патологический QS или Qr) с подъемом сегмента RS–Т, сохраняющимся более 2–3 недель от начала заболевания. Последний признак является наиболее надежным для диагностики аневризмы, свидетельствуя о наличии вокруг аневризмы обширной зоны повреждения тканей, вызванного постоянным механическим растяжением этих участков миокарда, возникающим при каждом сокращении сердца и выбухании стенки аневризмы (В.Н. Орлов, В.В. Мурашко и А.В. Струтынский и др.) (рис. 6.57).
3. Эхокардиографические признаки локального ограниченного выбухания (дискинезии) и истончения стенки ЛЖ. При двухмерной ЭхоКГ у больных с трансмуральным ИМ динамическая аневризма ЛЖ проявляется дискинезией миокарда в виде локальной деформации (выбухания) внутреннего контура ЛЖ только во время систолы желудочка (рис. 6.58). В отличие от этого истинная аневризма ЛЖ проявляется стойкой систолической и диастолической деформацией внутреннего контура и наличием резко выраженной демаркационной линии на границе с интактными сегментами (рис. 6.59).
4. Рентгенологически можно обнаружить лишь обширные аневризмы, захватывающие верхушку и переднебоковую стенку ЛЖ. В зависимости от периода ИМ, в котором обнаруживаются перечисленные признаки, различают острую и хроническую аневризму ЛЖ. Лечение Радикальное лечение аневризмы ЛЖ — хирургическое иссечение аневризматического мешка — показано в следующих случаях:
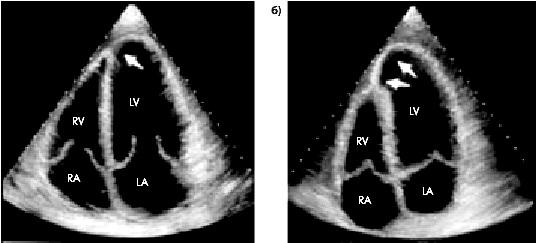
Разрывы сердца относятся к ранним и чрезвычайно тяжелым осложнениям трансмурального ИМ. В большинстве случаев они происходят в течение первых 7 дней от начала заболевания. После 2-х недель инфаркта разрывы встречаются очень редко, поскольку к этому времени в области инфаркта начинает формироваться плотный рубец, препятствующий возникновению разрывов. Различают внешние и внутренние разрывы сердца. При внешних разрывах кровь из полости ЛЖ быстро проникает в полость перикарда и развивается тампонада сердца, ведущая к его остановке. К внутренним разрывам относят разрывы МЖП и сосочковых мышц, что также приводит к тяжелым гемодинамическим нарушениям, резко ухудшающим прогноз ИМ. Разрывы сердца осложняют течение ИМ с зубцом Q в 3–6% случаев и наблюдаются преимущественно у больных старше 50–60 лет, особенно при наличии сопутствующей АГ. Преобладают внешние разрывы ЛЖ. Разрывы ПЖ встречаются крайне редко. Внешние разрывы Разрыв свободной стенки ЛЖ клинически чаще всего протекает молниеносно. Кровь из полости ЛЖ изливается в полость перикарда и возникает гемотампонада, приводящая к остановке сердца и мгновенной смерти. В других случаях быстро нарастающие клинические проявления разрыва сердца можно наблюдать в течение нескольких минут. У больного внезапно появляются интенсивные боли за грудиной, в области сердца, он теряет сознание. АД резко снижается или вовсе не определяется. Артериальный пульс становится нитевидным и исчезает совсем. С трудом прослушиваются тоны сердца. Появляется выраженный цианоз, быстро набухают шейные вены. На ЭКГ-мониторе в течение короткого времени продолжает определяться синусовый или эктопический ритм. Сердце сокращается, но кровь в аорту практически не поступает, а попадает в полость перикарда. Такое несоответствие между продолжающейся электрической активностью сердца и отсутствием механической (насосной) функции получило название “электромеханическая диссоциация”. При развитии тампонады сердца она очень быстро переходит в асистолию желудочков. В еще более редких случаях наблюдается подострый разрыв свободной стенки ЛЖ. Размеры такого надрыва стенки не столь велики, и он может даже частично тромбироваться. Поэтому кровь сравнительно медленно заполняет полость перикарда, и клиническая картина гемотампонады нарастает постепенно. Часто при таком варианте развития тампонады на первый план выступает болевой синдром, возникающий за несколько часов до развития тампонады и связанный с постепенно распространяющимся в толще миокарда надрывом стенки сердца и пропитыванием ее кровью (рис. 6.60).
Интенсивная боль за грудиной, быстрое падение АД, вновь выявляемый подъем сегмента RS–Т в нескольких отведениях ЭКГ очень напоминают клинику рецидивирующего ИМ, осложненного кардиогенным шоком. В этих условиях по понятным причинам очень опасно применение антикоагулянтов, тромболитической терапии или инотропных средств. Поэтому столь важна своевременная диагностика развивающейся гемотампонады. Она может быть основана на данных экстренной ЭхоКГ (выявление жидкости в полости перикарда) и результатах гемодинамического мониторинга (быстрое повышение ЦВД при сниженных величинах ДЗЛА). В этих случаях иногда (к сожалению, крайне редко) удается направить больного на экстренную хирургиргическую операцию.
Поиск по сайту: |
 Запомните
При гиповолемическом шоке критериями положительного эффекта внутривенного введения жидкости являются:
Запомните
При гиповолемическом шоке критериями положительного эффекта внутривенного введения жидкости являются: