 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Термодинамика идеальных растворов
Ищем химический потенциал компонента в растворе. Знаем, что при равновесии химический потенциал компонента i имеет одно и то же значение в жидкой фазе и в паре.
(1) Из условия химического равновесия (следующая глава) для смеси идеальных газов химический потенциал компонента i в газовой смеси выражается
(4.3)
Пусть раствор идеальный => подчиняется закону Рауля и химический потенциал компонента i в паре можно выразить через его мольную долю
Вернёмся к (1) соотношению
(4.4) Отсюда, если (4.4) - это есть определение идеальных растворов. Термодинамические соотношения для идеальных жидких растворов и газовых смесей (при меняется и для идеальных твёрдых растворов) близки. Для вычисления изобарного потенциала G двух жидкостей до и после их смешения с образованием идеального раствора можно воспользоваться
есть сумма вкладов всех компонентов. Т.е. изобарный потенциал n1 молей жидкости 1 и n2 молей жидкости 2 до смешения равен:
G смешения:
(4.5) где n=n1+n2. Отметим, что это уравнение тождественно уравнению для процесса смешения идеальных газов и их графики Двухкомпонентные системы, состоящие из твёрдых и жидких фаз. Рассмотрим смесь двух газов или двух жидкостей, будем считать, что они идеальны (все выводы совпадают). Поскольку мольные доли меньше 1, члены содержащие ln<0 и На рисунке Согласно (2.21) энтропию смешения двух жидкостей с образованием идеального раствора
(4.6)
Таким образом, идеальные газы (жидкости) смешиваются при постоянных T и P без теплового эффекта. Это соответствует тому, что между молекулами идеальных газов (жидкостей) нет ни притяжения, ни отталкивания. Следовательно, если рассматривать энергию системы, то нет разницы между случаями, когда газы (жидкости) смешаны и когда они изолированы друг от друга. "Движущая сила", приводящая к смещению, связана исключительно с изменениями энтропии. С точки зрения статистической физики, равновесию отвечает именно смесь, т.к. вероятность этого состояния больше. (Об этом мы говорили, когда рассматривали диффузию в кристаллах). Знаем, что
(2.21) при смешении идеальных газов. Или, (что тоже самое), при смешении компонентов с образованием идеального раствора объём не меняется. Отметим, что выведенные термодинамические соотношения применяются и для идеальных твёрдых растворов. С другой стороны, возможны случаи, когда компоненты не смешиваются в жидком состоянии или смешиваются в жидком состоянии и не смешиваются в твёрдом состоянии. (Пример: Bi-Cd).
Зависимость мольного потенциала Гиббса от состава системы в случае полной несмешиваемости компонентов. Говорят, что образуется смесь двух фаз (или механическая смесь).
4.3 Диаграмма TX (состав-Ткип) для бинарных растворов. До сих пор рассматривали диаграммы - сечения 3 мерной диаграммы плоскостью T const, в частности Pпара(Х). Рассмотрим сечение P const (верхняя грань параллелепипеда) Tкип(Х). Раствор закипает когда Сумма парциальных давлений (общее давление) = давлению внешнему.
Лежит ниже - на графиках Pпара(Х). Жидкость кипит при температурах, изображаемых нижней кривой.
Для практики имеет большое значение случай, когда растворённое вещество имеет пренебрежимо малое давление пара и Pпара
1 - растворитель. 2 - нелетучее растворённое вещество. Для неидеальных растворов это уравнение можно использовать, когда мольная доля растворённого вещества X2<<X1, следовательно можно пренебречь влиянием растворённого вещества на растворитель. Тогда:
В результате понижения P пара над раствором нелетучего вещества повышается температура кипения раствора, что позволяет вычислить молекулярный вес растворённого вещества. Для воды повышение ΔТкип в идеальном одномоляльном растворе нелетучего вещества
Поиск по сайту: |


 - парциальное уравнение компонента i
- парциальное уравнение компонента i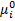 - µ компонента i при
- µ компонента i при  в растворе.
в растворе.


 - химический потенциал чистого жидкого компонента.
- химический потенциал чистого жидкого компонента.


 совпадают.
совпадают. смешения представлен как функция мольной доли одного из жидкостей (газов). Наименьшее значение
смешения представлен как функция мольной доли одного из жидкостей (газов). Наименьшее значение 

 Поскольку
Поскольку 


 Тогда потенциал Гиббса смешения как функция мольной доли одного из компонентов будет выглядеть так:
Тогда потенциал Гиббса смешения как функция мольной доли одного из компонентов будет выглядеть так: Кривая пара всегда лежит выше кривой жидкости на графиках зависимости Tкип(Х).
Кривая пара всегда лежит выше кривой жидкости на графиках зависимости Tкип(Х). Pпара растворителя. Для идеальных растворов давление пара растворителя определяется законами Рауля.
Pпара растворителя. Для идеальных растворов давление пара растворителя определяется законами Рауля.

 0,513K.
0,513K.