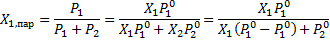|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Бинарные системы. Трёхмерная диаграмма T, P, X. Двухкомпонентный идеальный жидкий растворСтр 1 из 3Следующая ⇒
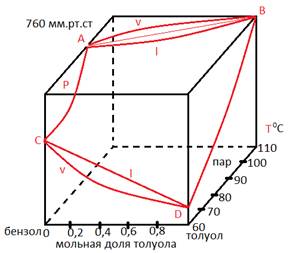
Глава 4 Введение. Приближение идеального газа можно применить к модели идеального раствора и использовать соответствующие термодинамические равенства. В случае идеальных растворов, в отличие от идеальных газов, нельзя пренебречь потенциальной энергией взаимодействия между молекулами по сравнению с кинетической энергией их теплового движения. Приближение идеальности в данном случае означает пренебрежимо малое различие в межмолекулярных взаимодействиях между однородными и разнородными молекулами в жидком растворе. Для этого разнородные молекулы должны иметь примерно одинаковые размеры и близкое химическое строение. Такими свойствами обладают жидкие растворы бензола и толуола, метилового и этилового спирта, твёрдые растворы изотопов различных веществ. Фазовые равновесия. Двухкомпонентные, трёхкомпонентные системы. Сначала рассмотрим жидкие идеальные растворы, посмотрим, какими термодинамическими величинами они характеризуются. Потом рассмотрим явления, связанные с выделением твёрдых фаз, твёрдые растворы. Бинарные системы. Трёхмерная диаграмма T, P, X. Двухкомпонентный идеальный жидкий раствор. Фазовые превращения в бинарной системе могут быть представлены трёхмерной диаграммой с координатами T, P, X (мольная доля). Простой случай рассмотрим на примере бинарной системы, где существует только пар и единственная жидкая фаза (не рассматриваем область равновесия между твёрдой и жидкой фазами).
АС - график зависимости Pпара от Тдля бензола. Две поверхности внутри параллелепипеда: верхняя (l) - общее давление пара как f(T, мольной доли толуола в жидкости0) нижняя (v) - изобарный состав пара, равновесного с жидкостью, его состав. Выше поверхности l - жидкость (жидкая фаза). Ниже поверхности v - пар. Область между поверхностями - сосуществование пара и жидкой фазы. Если существуют 4 фазы, то система инвариантна. Упростим: Рассмотрим сечение полной трёхмерной диаграммы плоскостями. На рисунке давление пара бензола и толуола над их бинарными растворами при T = const. Общее давление равно сумме парциальных давлений. Пусть T=const (600), (т.е. передняя грань), получим кривую l - общее давление пара l=p1+p2 в зависимости от состава жидкости. Оно складывается из парциальных давлений бензола и толуола. "PX" диаграмма:
Соотношение Рауля (закон Рауля 1884 год, для идеальных растворов). Из рисунка видно: давление пара бензола над смесями бензола и толуола пропорционально мольной доле бензола в растворе, коэффициент пропорциональности равен довлению пара чистого бензола (тоже для толуола). Пусть 1, 2 - компоненты бинарного раствора. p1=x1p10 p2=x2p20 (4.1) p10 - давление пара чистых компонентов при Т раствора. Общее давление = 1атм. При наличии воздуха существенных изменений не наблюдается. Растворы, подчиняющиеся закону Рауля, называются идеальными. Мольная доля компонента в паре равна доле, которую составляет его давление от общего давления пара, её можно рассчитать:
(4.2) Далее увидим, даже в случае неидеальных растворов, закон Рауля применим к компоненту, мольная доля которого в растворе
Поиск по сайту: |
 DB - график зависимости Pпара от Тдля толуола.
DB - график зависимости Pпара от Тдля толуола.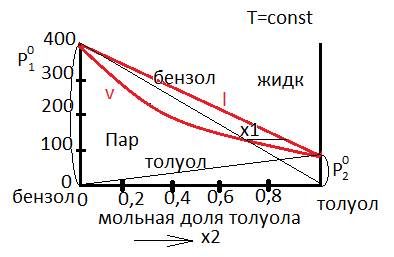 Кривая v - получается, если по вертикали по-прежнему откладывать общее давление, а по горизонтали - состав пара. Кривая пара (v) даёт те давления, при которых пар данного состава начинает конденсироваться, когда увеличивается P. Выше l - область жидкости. Ниже v - область пара. Между ними - область из жидкости и пара.
Кривая v - получается, если по вертикали по-прежнему откладывать общее давление, а по горизонтали - состав пара. Кривая пара (v) даёт те давления, при которых пар данного состава начинает конденсироваться, когда увеличивается P. Выше l - область жидкости. Ниже v - область пара. Между ними - область из жидкости и пара.