 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Проведение измерений в присутствии катализатора ⇐ ПредыдущаяСтр 9 из 9
- Изменения проводят так же; как в первом опыте, однако следует учитывать, что реакция идет быстрее. - Показания секундомера вносят в таблицу, указав в условиях опыта, сколько добавлено катализатора.
Обработка результатов эксперимента: Экспериментальную константу скорости рассчитывают по кинетическому уравнению 1-го порядка. Дляупрощения вычислений отношение концентраций под знаком логарифма заменяют отношением объемов, получая формулу, приведенную в таблице результатов эксперимента. Соответствие использованного уравнения реальному порядку реакции обнаруживается постоянством рассчитанных значений константы скорости с учетом неизбежного в эксперименте разброса результатов. Рассчитывают среднее значение констант скорости (k) (в разных условиях), энергию активации реакции в отсутствие и в присутствии катализатора (Ea, Ea(кат)), температурный коэффициент Вант-Гоффа (γ), период полупревращения (τ0,5) по формулам:
k =
Ea(кат) = Ea – ΔEa ; τ0,5 =
Расчеты:
Вывод (указывают полученные значения констант скорости при комнатной и повышенной температурах, константы скорости и энергии активации каталитической реакции, температурного коэффициента Вант-Гоффа):
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Поиск по сайту: |
 - В смесь реагирующих веществ до начала реакции добавляют от 1 до 4 капель разбавленного раствора молибдата аммония в качестве катализатора.
- В смесь реагирующих веществ до начала реакции добавляют от 1 до 4 капель разбавленного раствора молибдата аммония в качестве катализатора. ln
ln  ; Ea =
; Ea =  ; γ =
; γ = 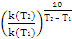 ; ΔEa = R ∙ T ∙ ln
; ΔEa = R ∙ T ∙ ln  ;
;
