 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Определение стандартной энтальпии реакции нейтрализации
Цель:научиться экспериментально определять изменение энтальпии реакции. Задание: определить стандартную энтальпию реакции нейтрализации азотной кислоты гидроксидом натрия. Оборудование:калориметр, мерные цилиндры, термометр, воронка. Реактивы:растворы азотной кислоты и гидроксида натрия. Сущность работы:теплота реакции нейтрализации определяется калориметрически по измеренному изменению температуры и рассчитанной теплоемкости системы.
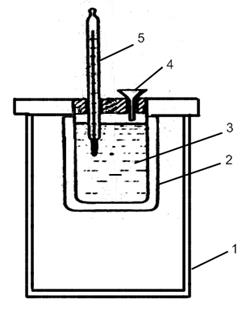
Лабораторный калориметр:
1 – внешний стакан, 2 – внутренний стакан, 3 – раствор, 4 – воронка, 5 – термометр.
Энтальпия реакции нейтрализации, протекающей между сильными одноосновными кислотами и сильными однокислотными основаниями практически не зависит от их природы, так как реально в растворах протекает одна и та же реакция: Н+(aq) + ОН–(aq) = Н2О(ж) ; DН°r = -57,3 кДж/моль. В случае реакции нейтрализации слабых кислот и слабых оснований такого постоянства не наблюдается, так как часть теплоты расходуется на ионизацию слабой кислоты и слабого основания. Выполнение эксперимента: 1. Подготавливают калориметр к работе. (Осматривают его, чтобы убедиться в исправности всех деталей. Ополаскивают дистиллированной водой внутренний стакан). 2. Мерными цилиндрами отмеривают равные объемы растворов кислоты и основания (20 – 25 мл, по указанию преподавателя). 3. Измеряют начальные температуры кислоты и щелочи с помощью термометра. 4. Раствор кислоты переливают при помощи воронки во внутренний стакан калориметра. 5. Раствор щелочи быстро вливают в калориметр к раствору кислоты и наблюдают за столбиком ртути термометра. Записывают самое высокое показание. Опыт повторяют 2 - 3 раза.
Масса внутреннего стакана калориметра, m (стакана) = ______ г Объемы растворов реагирующих веществ, V(HNO3) = _______ мл, V(NaOH) = _______ мл Концентрация растворов, c(HNO3) = _____ моль/л, c(NaOH) = _______ моль/л Плотность растворов, ρ(HNO3) = _______ г/мл, ρ(NaOH) = _______ г/мл Удельная теплоемкость растворов (воды), Cm(H2O) = 4,184 Дж/(г∙К) Удельная теплоемкость стекла, Сm(ст.) = 0,753 Дж/(г∙К)
Обработка результатов эксперимента: Для вычисления по экспериментальным данным теплоты реакций нейтрализации сначала рассчитывают общую теплоемкость калориметра Сm, учитывая теплоемкость раствора и теплоемкость внутреннего стакана:
Сm = Cm(H2O) ∙ m(раствора) + Сm(ст.) ∙ m(стакана)
где: m(раствора) = V(HNO3) ∙ ρ(HNO3) + V(NaOH) ∙ ρ(NaOH)
Затем вычисляют выделившуюся в калориметре теплоту: Q = Cm ∙ ΔT
где: ΔT = t(после нейтрализации) – Эта теплота постепенно, по мере выравнивания температуры передается в окружающую среду и может быть принята равной по абсолютной величине изменению энтальпии системы (калориметра): ΔnH = -Q
Для расчета стандартной энтальпии реакции нейтрализации найденное значение теплоты необходимо пересчитать на 1 моль реагирующей кислоты или основания, что соответствует 1 моль образующейся воды: ΔnH° = где: ν – количество вещества кислоты или щелочи (в зависимости от того, что находится в недостатке).
ν(HNO3) = V(HNO3) ∙ c(HNO3), или ν(NaOH) = V(NaOH) ∙ c(NaOH)
Рассчитанную стандартную энтальпию реакции нейтрализации сравнивают со справочными данными. Рассчитывают отклонение найденных значений от справочных. Объясняют вероятные причины отклонений.
Расчеты: 1) t01 = 2) ∆t0 = t2 – t1 =
3) Cр-ра = C0m(H2O)
4) V1 р-ра = Vк.
5) Сстак. = С0стак. mстак. =
6) Ссистемы = Сстак. + Cр-ра =
7) ∆H = -Q = -Ссист.
8) ν = Ск.
9) ∆nH0эксп. = Относительная ошибка: εотн.= ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вывод (указывают полученный результат, метод исследования, относительную ошибку): _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Занятие ___. Дата ____.____. 20___
Поиск по сайту: |
 Экспериментальные данные:
Экспериментальные данные:
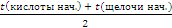

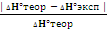

 =
= mр-ра =
mр-ра = ρк. + Vщ.
ρк. + Vщ.  ∆t =
∆t =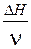 =
=
