|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Способы приготовления различных индикаторов ⇐ ПредыдущаяСтр 2 из 2
Розоловая кислота. Этот индикатор применяют в виде спиртово-водного раствора: 0,1 г розоловой кислоты растворяют в 10 мл чистого спирта, а затем добавляют 70 мл дистиллированной воды. Индикатор Андреде: кислого фуксина 1 г, дистиллированной воды 400 мл, раствора едкого натра 64 мл. После приготовления сутки выдерживают в термостате, 2 сут на свету. Сохраняют в темной бутыли. В кислой среде краснеет. Индикаторы Кларка. Готовят в виде спиртовых и водных растворов. Спиртовые растворы (1,6%) используют при приготовлении специальных питательных сред. Для определения реакции применяют водные растворы, так как они более чувствительны, чем спиртовые. Для приготовления водного раствора 0,1 г индикатора в порошке перетирают в агатовой ступке с 1/20 N раствором едкого натра. Разные индикаторы растворяют в разных количествах едкого натра: для фенолового красного требуется 5,7 мл, для метилового красного – 7,4 мл, для крезолового красного – 5,3 мл, для бром-крезолового красного – 3,7 мл, для бромтимолового синего – 3,2 мл, для тимолового синего – 4,3 мл. После растворения добавляют воды до 25 мл и получают 0,4% основные растворы, которые хранят впрок. Для определения реакции основные растворы разводят дистиллированной водой соответственно концентрации рабочего раствора (0,04–0,02% и т. д.). Для определения пути расщепления глюкозы (окислительный или бродильный) ставят тест ОФ (тест окисления/ферментации): культуру засевают уколом в две пробирки с полужидкой ПС, содержащей глюкозу и бромтимоловый синий. В одну из них вносят слой вазелинового масла (для создания анаэробиоза) и инкубируют обе пробирки при 37 °С. Образование кислоты, сопровождающееся пожелтением среды в обеих пробирках, свидетельствует о ферментативной реакции. Образование кислоты только в пробирке без масла свидетельствует об утилизации глюкозы путем окисления. Отсутствие кислотообразования в обеих пробирках свидетельствует о том, что тестируемые микроорганизмы не утилизируют глюкозу этими путями (см. цв. вклейку, рис. 9). В двух последних случаях микроорганизмы могут относиться к «неферментирующим» видам – Acinetobacter, Alcaligenes, Burkholderia, Flavimonas, Flavobacterium, Pseudomonas и др. Для выявления микробной нитратредуктазы ставят тест на восстановление нитрата в нитрит (последний в присутствии N,N-диметил-1-нафтиламина образует диазосоединение, которое окрашивает среду в красный цвет). Культуру выращивают на полужидкой среде, содержащей 0,1% нитрата, и добавляют смесь указанного реактива с сульфаниловой кислотой, наблюдая в течение нескольких минут за развитием красного окрашивания среды (свидетельствует о присутствии нитрита). Для определения каталазы на поверхность 24-часовой культуры на скошенном агаре наливают 0,5– 1,0 мл 3%-го раствора перекиси водорода (нельзя использовать кровяной агар, так как катализа эритроцитов может дать ложноположительную реакцию). Появление пузырьков газа расценивают как положительную реакцию. В качестве контроля следует параллельно исследовать культуру, заведомо содержащую каталазу. Биохимические свойства большого количества культур аэробных и анаэробных бактерий нередко изучают с применением специальных микротестсистем и микробиологических анализаторов. Как правило, для этого используют полистироловые пластины с изолированными лунками, содержащими высушенные дифференциально-диагностические среды. При внесении небольшого количества стандартизованной суспензии испытуемой чистой культуры среда в лунках восстанавливается, а при последующем инкубиро–вании в термостате культура вырастает в лунках, проявляя свои характерные изменения на соответствующих средах. Анализатор отличается от мультимикротестов тем, что учет, а в ряде приборов также посев и инкубирование осуществляется автоматически (мутность и цветовые изменения среды в каждой лунке регистрируются с помощью встроенного спектро–фотометра).
Антигенные свойства выделенной культуры изучают, как правило, с помощью реакции агглютинации. Вирулентность определяют путем выявления факторов патогенности, путем заражения экспериментальных животных, культур ткани или на экспериментальных моделях. Для определения чувствительности к антимикробным средствам культуру засевают на жидкие и плотные среды в соответствии с принятыми методами исследования.
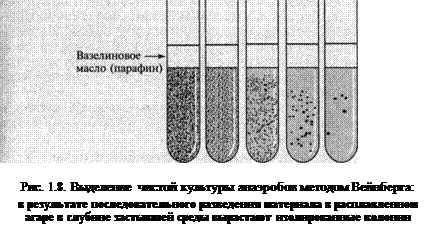
Характерные свойства бактерий, имеющие значение для их идентификации, приведены в разделах, посвященных лабораторной диагностике вызываемых ими заболеваний. В отдельных случаях для выделения чистой культуры возбудителя (чума, туляремия и др.) применяется биологическая проба. Анаэробные бактерии.Одним из основных требований при куль–тивировании анаэробных бактерий является создание анаэробной атмосферы, удаление кислорода из питательной среды и сниже–ние ее редокс-потенциала. Пониженное содержание кислорода создают следующими методами: применением специальных сред с редуцирующими вещества–ми – тиогликолевой кислоты, тиогликолята натрия, цистеина, глюкозы, кусочков печеночной (среда Китта–Тароцци) и моз–говой (среда Гиблера) ткани, мяса и др.; связыванием или замещением кислорода в герметически зак–рытых сосудах – анаэростатах, эксикаторах или специальных пла–стиковых мешках (рис. 1.7); изоляцией анаэробов в питательной среде от воздействия ат–мосферного кислорода (посев высоким столбиком в трубку или пробирку, заливка вазелинового масла на поверхность питатель–ной среды, метод Перетца и др.); использованием специальных анаэробных боксов (см. цв. вклей–ку, рис. 11). На первом этапе исследуемый материал для накопления анаэробов сеют в среду Китта–Тароцци (концентрированный 3*
МПБ или бульон Хоттингера, глюкоза, 0,15 % агар-агара, рН 7,2 – 7,4). На дно пробирки для адсорбции кислорода помещают кусоч–ки вареной печени или фарша слоем 1,0 – 1,5 см и заливают 6 – 7 мл среды. Среду перед посевом необходимо прогреть в кипящей водяной бане в течение 10 – 20 мин (для удаления растворенного в ней кислорода воздуха), а затем охладить. При выделении спо–ровых форм анаэробов засеянную среду вновь прогревают при тем–пературе 80 "С в течение 20–30 мин для уничтожения неспоровых форм бактерий. Посевы заливают вазелиновым маслом и помеща–ют в термостат. Кроме среды Китта–Тароцци, используют буль–он Хоттингера и Мартена, содержащий 0,5–1,0 % глюкозы и ку–сочки органов животных, тиогликолевую среду и др. Например, тиогликолевая среда состоит из гидролизата казеи–на – 15, дрожжевого и/или мясного экстракта – 5, глюкозы – 5,5, хлорида натрия – 2,5, L-цистеина и тиогликолята натрия – по 0,5, резазурина – 0,001, агар-агара – 0,75. Среду разливают в пробирки или флаконы, стерилизуют при 121 °С 15 мин и хранят в темном месте. В случае покраснения верхней части столбика среды более чем Уз, ее восстанавливают путем прогревания в кипящей водяной бане или в струе пара. На втором этапе учитывают изменения, происшедшие в среде накопления, а именно появление помутнения или помут–нения и газообразования. Бульонную культуру набирают пасте–ровской пипеткой, которую опускают через слой вазелинового масла на дно пробирки. Мазки готовят на стекле обычным спосо–бом, фиксируют в пламени и окрашивают по Граму. При микро–скопии отмечают морфологические признаки спорообразующих и неспорообразующих анаэробов (так, наличие крупных грампо-ложительных палочек позволяет заподозрить присутствие в мате–риале клостридий). Пересев из среды накопления делают на спе–циальные плотные питательные среды для анаэробов. Изолиро–ванные колонии обычно получают одним из двух нижеописанных способов. 1. 2. Выращивают анаэробные микроорганизмы в глубине плот–ной питательной среды (метод последовательных разведений Вейнберга). Культуру из среды берут пастеровской пипеткой с запаянным концом и переносят последовательно в 1, 2 и 3-ю пробирки с 10 мл ИХН. Затем продолжают производить разведе–ния в пробирках из тонкого стекла диаметром 0,8 см и высотой 18 см, перенося материал в 4, 5 и 6-ю пробирки с расплавлен–ным и охлажденным до 50 °С сахарным агаром или средой Виль–сона – Блера. После застывания агара посевы помещают в термо–стат. Для приготовления среды Вильсона –Блера к 100 мл рас–плавленного МПА, содержащего 1 % глюкозы, добавляют 10 мл 20%-го раствора сульфита натрия и 1 мл 8%-го раствора хлорида железа.
Рис. 1.9. Образец хроматограммы, полу–чаемой для идентификации анаэробов по составу и количеству летучих жир–ных кислот
На третьем этапе изучают роцци для накопления чистой куль–туры и инкубируют при 37 °С. На четвертом этапе выросшую на среде Китта–Тароц–ци культуру проверяют на чистоту и идентифицируют по морфо–логическим, культуральным, биохимическим, антигенным и дру–гим свойствам (см. выше). Иногда для идентификации выделен–ных культур (или прямого обнаружения анаэробов в исследуемом материале) методом газожидкостной хроматографии определяют характерные метаболиты анаэробного «дыхания» – летучие жир–ные кислоты (рис. 1.9) На пятом этапе учитывают результаты исследования и анализируют их.
Поиск по сайту: |