 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сделать вывод о химических свойствах альдегидов и кетонов, отметить их общие химические свойства и различия их химических свойств.
Контрольные вопросы.
1. Напишите общую формулу гомологического ряда предельных альдегидов. 2. Укажите тип гибридизации атомов углерода в карбонильной группе. 3. Напишите структурные формулы возможных изомеров состава C 3H6O. Назовите их. 4. Составьте структурные формулы веществ: 3,3-диметилбутаналя;3-метил-2-этилпентаналя; 2-метилпропаналя; бутаналя; метилэтилкетона; 2,2-диэтилпропаналя. Укажите формулы гомологов и изомеров. 5. Одним реактивом распознайте глицерин, формальдегид, этиловый спирт. Напишите уравнения реакций. 6. Опишите, как можно различить: бензен, ацетальдегид, гексен. Напишите уравнения соответствующих реакций. 7. Какие методы можно использовать для получения изомасляного альдегида; метил-втор-бутилкетона; бензальдегида? Напишите уравнения соответствующих реакций. 8. Укажите, какие вещества из приведенных могут реагировать между собой: глицерин, бромная вода, формальдегид, гидроксид меди(II), фенол, этанол, хлороводород. Напишите уравнения соответствующих химических реакций, используя структурные формулы органических соединений. Назовите образующиеся вещества. 9. Составьте структурную формулу метаналя, укажите валентность и степень окисления атомов углерода и напишите уравнения реакций, в которых метаналь является: а) окислителем; б) восстановителем. 10. Напишите уравнения реакций следующих превращений : метан → ацетилен → ацетальдегид → этанол → этилен → этан.
Лабораторная работа № 7. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ. Цель работы: изучение химических свойств карбоновых кислот. Оборудование: спиртовки, пробирки, газоотводные трубки, химические стаканы.
Реактивы:
Методика проведения исследования: ОПЫТ 1. КИСЛОТНЫЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
Выполнение работы.
В четыре пробирки помещают по 5 капель уксусной, лимонной, щавелевой, молочной кислот (каждую кислоту в отдельную пробирку) и добавляют по 1 капле метилового оранжевого, а в следующие четыре пробирки с указанными кислотами добавляют по 1 капле фенолфталеина.
ОПЫТ 2. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ.
Выполнение работы.
В две пробирки налить по 5 капель уксусной кислоты и в одну пробирку добавить стружки магния, а в другую – кусочки цинка. Аналогичные опыты проделать с остальными кислотами. Выделяется водород и образуются соли. Если с цинком реакция протекает медленно, то реакционную смесь нагревают.
ОПЫТ 3. ВЗАИМОДЕЙСТВИЕ УКСУСНОЙ КИСЛОТЫ С ОКСИДОМ МЕДИ И КАРБОНАТОМ НАТРИЯ.
Выполнение работы.
а) К 0,1 г оксида меди (II), помещенного в пробирку, приливают 10 капель уксусной кислоты, затем пробирку осторожно нагревают. Обращают внимание на цвет раствора. Напишите уравнение химической реакции. б) К 10 каплям 10% раствора карбоната натрия приливают 5 капель ледяной уксусной кислоты. Напишите уравнение химической реакции и опишите происходящие изменения.
ОПЫТ 4. ОБРАЗОВАНИЕ И ГИДРОЛИЗ УКСУСНОКИСЛОГО ЖЕЛЕЗА.
Выполнение работы.
В пробирку помещают несколько кристалликов уксуснокислого натрия, 3 капли воды 2 капли раствора хлорида железа (III). Раствор окрашивается в желтовато-красный цвет в результате образования железной соли уксусной кислоты. Раствор нагревают до кипения. Тотчас же выпадают хлопья основных солей красно-бурого цвета.
Химизм процесса:
ОПЫТ 5. РАЗЛОЖЕНИЕ ЩАВЕЛЕВОЙ КИСЛОТЫ ПРИ НАГРЕВАНИИ. Выполнение работы.
Несколько кристаллов щавелевой кислоты нагревают в пробирке с газоотводной трубкой, конец которой опущен в пробирку с известковой водой. Газ, выделяющийся при нагревании, вызывает помутнение известковой воды. После этого газоотводную трубку вынимают из пробирки с известковой водой и поджигают выделяющийся газ. Химизм процесса:
нагревание
HOOC-COOH CO 2 + HCOOH
ОПЫТ 6. ОКИСЛЕНИЕ ЩАВЕЛЕВОЙ КИСЛОТЫ ПЕРМАНГАНАТОМ КАЛИЯ. Выполнение работы. В пробирку помещают несколько кристаллов кислоты, добавляют 2 капли перманганата калия и 1 каплю серной кислоты. Отверстие пробирки закрывают пробкой с газоотводной трубкой, конец которой опущен в пробирку с известковой водой. Реакционную смесь нагревают. Розовый раствор перманганата калия обесцвечивается, а в пробирке с известковой водой появляется белый осадок карбоната.
Химизм процесса:
Щавелевая кислота обладает восстановительными свойствами.
ОПЫТ 7. ПРИСОЕДИНЕНИЕ БРОМА К ОЛЕИНОВОЙ КИСЛОТЕ.
Выполнение работы.
В пробирку вносят 3-4 капли бромной воды, 1 каплю олеиновой кислоты и энергично взбалтывают. Бромная вода обесцвечивается. Химизм процесса:
CH3(CH2)7-CH=CH-(CH2)7-COOH + Br2 →
→ CH3(CH2)7-CHBr-CHBr-(CH2)7-COOH дибромстеариновая кислота
ОПЫТ 8. ОКИСЛЕНИЕ ОЛЕИНОВОЙ КИСЛОТЫ ПЕРМАНГАНАТОМ КАЛИЯ.
Выполнение работы.
В пробирку помещают по 2 капли олеиновой кислоты, раствора карбоната натрия и раствора перманганата калия. При встряхивании смеси розовая окраска исчезает. Химизм процесса:
CH3-(CH2)7 – CH ― CH - (CH2)7 – COOH | | OH OH
Обесцвечивание бромной воды и раствора перманганата калия указывает на наличие кратной связи в молекуле олеиновой кислоты.
ОПЫТ 9. КИСЛОТНЫЕ СВОЙСТВА СТЕАРИНА.
Выполнение работы.
В две сухие пробирки помещают по 4 капли диэтилового эфира. В одну пробирку добавляют маленький кусочек стеарина и растворяют его в диэтиловом эфире без нагревания. В обе пробирки прибавляют по 1 капле фенолфталеина, по 1 капле раствора едкого натра и тщательно встряхивают. В пробирке, содержащей стеарин, появившееся вначале малиновое окрашивание при перемешивании исчезает. В пробирке с эфиром и щелочью появляется стойкая малиновая окраска.
Химизм процесса:
Стеарин представляет собой смесь стеариновой и пальмитиновой кислот. Реагируя со щелочью, они образуют соли, вследствие чего в растворе отсутствуют ионы OH-.
ОПЫТ 10. ПОЛУЧЕНИЕ БЕНЗОЙНОКИСЛОГО КАЛИЯ И ЖЕЛЕЗА.
Выполнение работы.
В пробирку помещают несколько кристаллов бензойной кислоты и прибавляют 3 капли раствора едкого кали. Встряхивают содержимое пробирки. Кристаллы растворяются. Химизм процесса:
Соли бензойной кислоты со щелочными металлами хорошо растворимы в воде, поэтому бензойная кислота растворима в щелочах. Разделите содержимое пробирки на две части. В одну пробирку к раствору бензойнокислого калия добавляют 2-3 капли раствора соляной кислоты. Снова выпадает бензойная кислота:
В другую пробирку к раствору бензойнокислого калия приливают 3-4 капли 2% раствора хлорида железа. Сразу же образуется бензойнокислое железо, которое осаждается в виде объемистого бурого осадка:
ОПЫТ 11. ОБРАЗОВАНИЕ ФТАЛЕВОГО АНГИДРИДА.
Выполнение работы.
Орто-фталевая кислота при нагревании легко теряет воду и превращается в вещество белого цвета, так называемый фталевый ангидрид:
O
O
В сухую пробирку насыпают несколько кристаллов фталевой кислоты и нагревают ее в пламени горелки, держа пробирку горизонтально. При этом образуется фталевый ангидрид, который сублимируется и вновь конденсируется на холодных стенках пробирки. Пробирке дают остыть и приливают 3-4 капли бензола. При взбалтывании фталевый ангидрид легко растворяется в бензоле.
ОПЫТ 12. СВОЙСТВА УКСУСНОГО АНГИДРИДА.
Выполнение работы.
а) Взаимодействие уксусного ангидрида со щелочью. В пробирку наливают 10 капель воды, прибавляют 2 капли уксусного ангидрида и взбалтывают. Растворение не наблюдается. Затем приливают несколько капель 10% раствора едкого натра и снова взбалтывают. При этом происходит гидролиз уксуснокислого ангидрида с образованием уксуснокислого натрия:
б) Взаимодействие уксусного ангидрида с этиловым спиртом. В пробирку наливают 10 капель уксусного ангидрида и 10 капель этилового спирта, раствор нагревают несколько минут на водяной бане при температуре 60-700С. После этого смесь выливают в равный объем воды и нейтрализуют раствором соды. Образовавшийся уксусноэтиловый эфир отделяется в верхнем слое. Его узнают по характерному запаху:
в) Взаимодействие уксусного ангидрида с анилином. В пробирку наливают 10 капель воды, прибавляют 4 капли анилина и сильно взбалтывают. К образовавшейся эмульсии добавляют 4 капли уксусного ангидрида и вновь энергично встряхивают. При этом наблюдается сильное разогревание смеси, которая в скором времени превращается в сплошную массу белых кристаллов образовавшегося ацетанилида (фенилацетамида):
Поиск по сайту: |
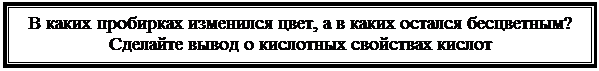

 Fe(CH3COO)3 + HOH Fe(OH)(CH3COO)2 + CH3COOH
Fe(CH3COO)3 + HOH Fe(OH)(CH3COO)2 + CH3COOH Fe(OH)(CH3COO)2 + HOH Fe(OH)2(CH3COO) + CH3COOH
Fe(OH)(CH3COO)2 + HOH Fe(OH)2(CH3COO) + CH3COOH Fe(OH)2(CH3COO) + HOH Fe(OH)3 + CH3COOH
Fe(OH)2(CH3COO) + HOH Fe(OH)3 + CH3COOH HOOC-COOH· 2H2O HOOC-COOH + 2H2O
HOOC-COOH· 2H2O HOOC-COOH + 2H2O
 2KMnO4 + 5HOOC-COOH + 3H2SO4 K2SO4 + 2MnSO4 +10CO2 + 8H2O
2KMnO4 + 5HOOC-COOH + 3H2SO4 K2SO4 + 2MnSO4 +10CO2 + 8H2O CO2 + Ca(OH)2 CaCO3↓ + H2O
CO2 + Ca(OH)2 CaCO3↓ + H2O CH3 - (CH2)7 – CH = CH - (CH2)7 - COOH + [O] + HOH
CH3 - (CH2)7 – CH = CH - (CH2)7 - COOH + [O] + HOH C17H35COOH + NaOH C17H35COONa + H2O
C17H35COOH + NaOH C17H35COONa + H2O C15H31COOH + NaOH C15H31COONa + H2O
C15H31COOH + NaOH C15H31COONa + H2O C6H5COOH + KOH C6H5COOK + H2O
C6H5COOH + KOH C6H5COOK + H2O C6H5COOK + HCl C6H5COOH + KCl
C6H5COOK + HCl C6H5COOH + KCl 3C6H5COOK + FeCl3 (C6H5-COO)3Fe + 3KCl
3C6H5COOK + FeCl3 (C6H5-COO)3Fe + 3KCl


 COOH C
COOH C



 O
O COOH C
COOH C




 C6H5NH2 + (CH3-CO)2O C6H5NHCOCH3 + CH3COOH
C6H5NH2 + (CH3-CO)2O C6H5NHCOCH3 + CH3COOH