 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сделайте вывод о химических свойствах карбоновых кислот. Дайте сравнительную характеристику карбоновых и минеральных кислот.
Контрольные вопросы.
1. Какую функциональную группу содержат карбоновые кислоты. 2.Напишите общую формулу одноосновных предельных карбоновых кислот. 3. Укажите тип гибридизации атома углерода в карбоксильной группе. 4. Напишите уравнения химических реакций, характеризующих химические свойства карбоновых кислот. 5. Составьте структурные формулы четырех изомерных карбоновых кислот, соответствующих формуле C 5H10О 2. Назовите их. 6. Составьте уравнения реакций следующих превращений, используя структурные формулы органических веществ: а) пропаналь →пропионовая кислота →пропионат натрия → этан → этин → ацетальдегид; б) метанол → метаналь → муравьиная кислота → оксид углерода (IV). 7. Укажите, какие вещества вступили в реакцию, и при каких условиях, если в результате образовались следующие вещества: а) (CH 3COO) 2Mg + H 2 ; б) CH 3COOCH3 + H 2O; в) 2CH 3COONa + H 2O + CO 2.
ЛАБОРАТОРНАЯ РАБОТА № 8
ГАЛОГЕНРОИЗВОДНЫЕ ПРЕДЕЛЬНЫХ И АРОМАТИЧЕСКИХ
УГЛЕВОДОРОДОВ
Цель работы: изучение химический свойств галогенпроизводных углеводородов.
Оборудование: микроскоп, термометр, водяная баня, спиртовки, штатив, пробирки, пипетки, микрошпатель, предметные стекла, газоотводные трубки, стеклянная трубка-поглотитель с натронной известью, ватный тампон.
Реактивы:
Методика проведения исследования.
Опыт 1. ПОЛУЧЕНИЕ БРОМИСТОГО ЭТИЛА. Выполнение работы.
В пробирку с отводной трубкой помещают 3 капли спирта, 2 капли воды и 3 капли серной кислоты. Охладив разогревшуюся спирто-кислотную смесь, в нее на конце микрошпателя помещают несколько кристаллов бромида калия. Пробирку укрепляют наклонно в лапке штатива и осторожно нагревают содержимое пробирки до кипения. Конец отводной трубки погружают в другую пробирку, содержащую 6-7 капель воды и охлаждаемую льдом. Нагревание ведут до исчезновения кристаллов бромида кадия в реакционной пробирке. В приемнике образуются два слоя: нижний - бромистый этил, верхний - вода. С помощью пипетки удаляют верхний слой. Стеклянной палочкой вносят 1 каплю бромистого этила в пламя горелки. Пламя окрашивается по краям в зеленый цвет. Химизм процесса:
Наиболее удобным способом получения галогеналкилов является замещение гидроксильной группы спиртов R - ОН на галоген. Способ получения галогенопроизводных из спиртов используется в больших масштабах, так как спирты - легкодоступные и хорошо изученные соединения. В некоторых случаях при получении галогеналкилов вместо галогеноводородов применяют галогениды фосфора. ОПЫТ 2. ПОЛУЧЕНИЕ ХЛОРИСТОГО ЭТИЛА.
Выполнение работы.
В пробирку насыпают мелкие кристаллы хлорида натрия (слой высотой I мм), затем добавляют 3 капли этилового спирта, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки. Время от времени подносят отверстие пробирки к пламени горелки. Выделяющийся хлористый этил загорается, образуя характерное колечко, окрашенное в зеленый цвет. Химизм процесса:
C2H5-O-SO3H + HCl C2H5Cl + H2SO4
Хлористый этил - газ, легко сгущается в жидкость с ТК=12,40 С. ОПЫТ 3 . ПОЛУЧЕНИЕ ЙОДОФОРМА ИЗ ЭТИЛОВОГО СПИРТА
Выполнение работы. В пробирку помещают I каплю этилового спирта, 3 капли раствора йода в иодиде калия и 3 капли раствора едкого натра. Содержимое пробирки нагревают, не допуская закипания раствора, так как в кипящем растворе йодоформ расщепляется щелочью. Появляется беловатая муть, из которой постепенно при охлаждении образуются кристаллы йодоформа. Если муть растворяется, то добавляют еще 3-4 капли раствора йода к теплой реакционной смеси и тщательно перемешивают содержимое пробирки, пока не начнется выделение кристаллов. Две капли осадка переносят на предметное стекло и рассматривают их под микроскопом. Кристаллы йодоформа имеют вид шестиугольников или шестиконечных снежинок.
Химизм процесса:
Йодоформ образует кристаллы желтого цвета с Тпл = 1190С, обладает сильным, очень навязчивым запахом. Это прекрасный антисептик.
ОПЫТ 4. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ ГАЛОГЕНА В АЛКИЛГАЛОГЕНИДАХ.
Выполнение работы. . а) ЩЕЛОЧНОЙ ГИДРОЛИЗ АЛКИЛГАЛОГЕНИДОВ. В пробирки наливают по 5 капель исследуемых алкилгалогенидов и 2 раза промывают их водой. Для этого к алкилгалогениду добавляют дистиллированную воду - 20 капель, встряхивают смесь и после расслоения сливают воду и промывание повторяют. После этого к алкилгалогенидам добавляют 20 капель 10% раствора гидроксида натрия и встряхивают содержимое пробирок. Затем при постоянном перемешивании осторожно доводят смесь до кипения. (Кипятить нельзя, так как алкилгалогенид может испариться!). После охлаждения отливают 10 капель щелочного раствора в другую пробирку, подкисляют его 20% раствором азотной кислоты и добавляют несколько капель 1% раствора нитрата серебра. Количество образующегося осадка AgCl или АgBr зависит от подвижности галогена в алкилгалогениде.
б) ВЗАИМОДЕЙСТВИЕ АЛКИЛГАЛОГЕНИДОВ СО СПИРТОВЫМ РАСТВОРОМ НИТРАТА СЕРЕБРА
Для опыта используют несколько алкилгалогенидов, предварительно промытых водой. В сухие пробирки наливают по 10 капель насыщенного раствора (спиртового) нитрата серебра и добавляют по 1 капле промытых водой алкилгалогенидов. Смесь в каждой пробирке встряхивают и отмечают, выпадает ли осадок на холоду, затем нагревают пробирки в кипящей водяной бане в течение 1 мин. Охлаждают пробирки и сравнивают количества выпавших осадков. Чем больше выпадает осадка, тем выше подвижность галогена в исходном алкилгалогениде. ОПЫТ 5. ЦВЕТНАЯ РЕАКЦИЯ НА ХЛОРОФОРМ.
Выполнение работы.
В пробирку наливают 5 капель резорцина, 1% раствор; 10 капель гидроксида натрия и 5 капель хлороформа. Смесь нагревают. Появляется желто-красное окрашивание. ОПЫТ 6. ЗАМЕЩЕНИЕ ГАЛОГЕНОВ НА ГИДРОКСИЛЫ ДЕЙСТВИЕМ ЩЕЛОЧИ.
Выполнение работы.
К 5 каплям хлороформа в пробирке приливают 20 капель 10%-го раствора едкого натра и осторожно при частом взбалтывании нагревают смесь до начала кипения. Смесь охлаждают, дают отстояться и сливают часть водно-щелочного слоя. К водно-щелочному слою прибавляют кислоту до явно кислой реакции (проба на лакмус) и приливают несколько капель 1%-го раствора нитрата серебра. Наблюдают образование белого осадка хлористого серебра, нерастворимого в азотной кислоте.
Химизм процесса:
Если проводить опыт параллельно с несколькими галогенопроизводными предельных углеводородов, то, сравнивая количества образовавшегося осадка галоидного серебра, можно сделать вывод о легкости замещения галогена. В одинаковых по своему строению галогенопроизводных легкость замещения галогена падает в следующей последовательности: R-I > R-Br > R-Cl > R-F.
ОПЫТ 5. ПОЛУЧЕНИЕ БРОМБЕНЗОЛА.
Выполнение работы.
Опыт проводят в вытяжном шкафу. В сухую пробирку помещают немного железных опилок, 5 капель бензена и 2 капли брома. Отверстие пробирки сразу же закрывают пробкой с газоотводной трубкой. Реакция начинается немедленно, смесь при этом почти не разогревается. После того, как в реакционной пробирке прекратится выделение пузырьков НВr и исчезнут окрашенные пары брома, ее помещают в водяную баню и нагревают 2 мин. при температуре 60-700С. Полученный бромбензен охлаждают и промывают от следов брома раствором едкого натра почти до обесцвечивания. Верхний водный слой отбирают при помощи пипетки. С бромбензеном проводят качественную реакцию на галоген. Химизм процесса:
ОПЫТ 8. ВЛИЯНИЕ КАТАЛИЗАТОРОВ НА ХОД БРОМИРОВАНИЯ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ Выполнение работы.
Поиск по сайту: |







 NaCl + H2SO4 HCl + NaHSO4
NaCl + H2SO4 HCl + NaHSO4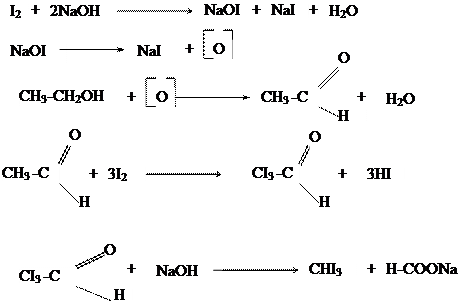
 C2H5Cl + NaOH C2H5OH + NaCl
C2H5Cl + NaOH C2H5OH + NaCl AgNO3 +NaCl AgCl↓ +NaNO3.
AgNO3 +NaCl AgCl↓ +NaNO3.
 2Fe + 3Br2 2FeBr3
2Fe + 3Br2 2FeBr3 C6H6 + Br2 C6H5Br + HBr
C6H6 + Br2 C6H5Br + HBr