 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
(АМИНЫ И НИТРОСОЕДИНЕНИЯ)
Цель работы: изучение химических свойств азотсодержащих органических соединений.
Оборудование: микроскоп, технохимические весы, водяная баня, спиртовки, пробирки, предметные стекла, стеклянные палочки, микрошпатель, Реактивы:бензен, азотная кислота концентрированная (ρ=1,4 г∕мл3); серная кислота концентрированная (ρ=1,84 г∕мл3); кислота серная, 0,2 н раствор; кислота серная, 2 н раствор; толуен; нафтален (порошок); мочевина (порошок); мочевина, концентрированный раствор; вода дистиллированная; известковая вода; гидроксид натрия, 40 %-ный раствор; гидроксид натрия, 2н раствор; сульфат меди, 2%-ный раствор; соляная кислота, концентрированная (ρ=1,19 г/мл3); хлорная известь, насыщенный раствор; дихромат калия, 0,5 н раствор; бромная вода, насыщенный раствор; анилин; хлористый ацетил; уксусный ангидрид; формалин, 40%-ный раствор; уксусная кислота ледяная; метиловый спирт, лигнин (газетная бумага, личинка). Индикаторы: фенолфталеин, 1%-ный спиртовый раствор; лакмусовая бумага красная. Методика проведения исследования.
О П Ы Т № 1. ПОЛУЧЕНИЕ НИТРОБЕНЗЕНА.
Выполнение работы.
В сухую пробирку помещают 2 капли концентрированной азотной кислоты и 3 капли концентрированной серной кислоты. Полученную нитрующую смесь охлаждают и добавляют 2 капли бензена. Пробирку помещают в водяную баню, нагретую до 50-55°С, на 2-3 мин., постоянно встряхивая содержимое пробирки. После этого выливают реакционную смесь в заранее приготовленную пробирку с водой. На дно опускается капля тяжелого, чуть желтоватого нитробензена, мутного от присутствия влаги. Химизм процесса:
C 6H6 + HONO2 → C 6H 5NO2 + H 2O
Активной формой нитрующего агента является катион нитрония +NO2, образующийся при действии серной кислоты на азотную:
HO-NO2 + 2H2 SO4 ↔ +NO2 + 2HSO4-- + [H3O]+
Ион гидроксония [H3O]+ образуется из протона H+ и молекулы воды в водных растворах минеральных кислот. Катион нитрония реагирует с ароматическим углеводородом:
NO2 π – комплекс очень неустойчивый σ - комплекс
Скорость реакции нитрования зависит от объекта нитрования и состава нитрующей смеси. Для каждого соединения существует оптимальный состав.
О П Ы Т № 2. ПОЛУЧЕНИЕ ДИНИТРОБЕНЗЕНА.
Выполнение работы.
В пробирку помещают 2 капли азотной кислоты и 3 капли серной кислоты. К горячей нитрующей смеси приливают 2 капли нитробензена и нагревают в кипящей водяной бане при постоянном взбалтывании 3-4 мин. Затем реакционную смесь охлаждают и выливают в пробирку с водой. Динитробензен вначале выделяется в виде тяжелой маслянистой капли, затем быстро переходит в кристаллическое состояние. Химизм процесса:
C 6H 5NO2 + HO-NO2 →C 6H4 (NO)2 + H 2O
Нитрогруппа относится к заместителям второго рода. Поэтому она уменьшает способность ароматического ядра к реакциям электрофильного замещения. Для введения второй нитрогруппы требуется большая длительность нитрования и более высокая температура, чем при получении мононитробензена. Для получения мононитробензена нужна температура 50°С, а для получения динитробензена -90°.
О П Ы Т № 3. Нитрование толуена.
В пробирке готовят нитрующую смесь из 2 капель концентрированной азотной кислоты и 3 капли концентрированной серной кислоты. К нитрующей смеси приливают 2 капли толуена и энергично встряхивают содержимое пробирки. Через 1-2 минуты реакционную смесь выливают в пробирку с водой. На дно опускается тяжелая капля нитротолуена:
При нагревании толуена получается смесь о- и п- нитротолуенов. В зависимости от условий нитрования относительные количества о- и п-изомеров в этой смеси различны. Гомологи бензена нитруются легче, чем бензен.
О П Ы Т № 4 ПОЛУЧЕНИЕ НИТРОНАФТАЛЕНА.
Выполнение работы.
К 20 каплям концентрированной азотной кислоты добавляют 0,5 г. нафталена в порошке: при встряхивании смесь начинает желтеть уже на холоду. Нагревают смесь в кипящей водяной бане 5 мин. при частом встряхивании выделяется в виде оранжевого масла, быстро твердеющего при встряхивании. Продуктом реакции является преимущественно нитронафтален.
H2SO4
О П Ы Т № 5. СВОЙСТВА МОЧЕВИНЫ Выполнение работы.
а) Гидролиз мочевины. 0,5 – 1 г. мочевины помещают в пробирку и растворяют в 4 - 5 мл воды. К раствору добавляют баритовой или известковой воды и кипятят. Наблюдают образование нерастворимого белого осадка углекислого бария или кальция, а выделяющиеся пары имеют характерный запах аммиака и окрашивают лакмусовую бумажку в синий цвет. Процесс гидролиза мочевины можно выразить схемой:
NH2 OH
CO2 + Ba(OH)2 → BaCO3↓ + H2O. б) Образование солей. В пробирку к 3-4 мл концентрированного раствора мочевины прибавляют небольшое количество концентрированной азотной кислоты. При этом происходит разогревание смеси. При охлаждении реакционной смеси выпадает в осадок трудно растворимая в воде соль - азотнокислая мочевина. Мочевина обладает слабыми основными свойствами и поэтому способна образовывать соли с одним эквивалентом кислоты:
NH2 NH2
в) Взаимодействие мочевины с азотной кислотой. В пробирку помещают 2-3 мл 3 %- ного раствора мочевины, приливают равный объем 3%-ного раствора азотокислого натрия, и смесь осторожно подкисляют разбавленной серной кислотой. Наблюдают выделение пузырьков азота и углекислого газа:
NaNO2 + H2SO4 → HNO2 + NaHSO4
NH2
Эта реакция применяется для количественного определения мочевины по объему выделившегося газа-азота. г) Образование биурета. В пробирке осторожно нагревают 0,5г. сухой мочевины. При этом сначала мочевина плавится, а затем происходит обильное выделение аммиака (что легко узнают по характерному запаху или по посинению смоченной лакмусовой бумажки); и затвердевание расплавленной массы. Нагревание прекращают после того, как расплавившаяся масса снова затвердевает. Пробирку охлаждают, добавляют 3-4 мл воды, и продукт реакции растворяют при слабом нагревании. К полученному раствору прибавляют 1-1 мл 10%-ного раствора едкого натра и 1-2 капли 2%-ного раствора медного купороса и встряхивают раствор окрашивают в характерный ярко-фиолетовый цвет вследствие образования комплексного медного соединения биурета:
(NH2CONHCONH2 )2 · 2KOH · Cu(OH)2
NH2-CO-NH2 + NH2-CO-NH2 → NH2-CO-NH-CO-NH2 +NH3 биурет
О П Ы Т 6. ОБРАЗОВАНИЕ СОЛЕЙ АНИЛИНА И ИХ РАЗЛОЖЕНИЕ.
Выполнение работы.
а) В пробирку помещают 1 каплю анилина, 8 капель воды и встряхивают содержимое пробирки. Одну каплю, эмульсии наносят на лакмусовую бумажку. Цвет красного лакмуса не меняется. б) Приготовленную эмульсию анилина делят на две части. К одной части добавляют по каплям раствор серной кислоты. Образуется осадок сернокислого анилина. Нагревают пробирку до растворения осадка и медленно охлаждают. Выпавшие игольчатые кристаллы переносят на предметное стекло и рассматривают их форму в микроскоп. Химизм процесса:
кислый сернокислый анилин
в) К другой части эмульсии анилина добавляют по каплям концентрированную соляную кислоту до получения однородного раствора. К прозрачному раствору солянокислого анилина добавляют 1-2 капли фенолфталеина и по капля раствор щелочи. Жидкость мутнеет еще до появления малиновой окраски. Химизм процесса:
солянокислый анилин
Основные свойства аминогруппы, связанной с ароматическим ядром, значительно ослаблены по сравнению с аминами жирного ряда. Водный раствор анилина не окрашивает лакмус в синий цвет. Анилин образует соли только с сильными минеральными кислотами. Водные растворы этих солей имеют, кислую реакцию и их можно титровать щелочами.
О П Ы Т № 7. ЦВЕТНЫЕ РЕАКЦИИ АНИЛИНА.
Выполнение работы.
а) Цветная реакция с лигнином. В пробирку помещают I каплю анилина, 5 капель воды и по каплям добавляют соляную кислоту до образования прозрачного раствора солянокислого анилина. Каплю этого раствора наносят на полоску газетной бумаги. Появляется желто-оранжевое окрашивание. Лучинка, опущенная в раствор солянокислого анилина, также окрашивается в желто-оранжевый цвет. Окрашивание обусловлено присутствием в бумаге и древесине лигнина. Если раствором соли анилина смочить полоску фильтровальной бумаги, окрашивание не произойдет, так как фильтровальная бумага представляет собой чистую клетчатку без примеси лигнина. б) Цветная реакция с хлорной известью. Готовят раствор солянокислого анилина и каплю раствора наносят на предметное стекло. Добавляют каплю раствора хлорной извести. Появляется темно-зеленое окрашивание, переходящее в синее, а затем в черное. Эти реакции основаны на легкой окисляемости анилина. Конечным продуктом является «черный анилин» - краситель для хлопчатобумажных тканей.
О П Ы Т № 8. БРОМИРОВАНИЕ АНАЛИНА.
Выполнение работы.
В пробирку помещают 3 капли бромной воды и I каплю анилиновой воды. Выпадает белый осадок тримброманилина:
NH2 NH2
Br
триброманилин
Являясь электронодонорным заместителем, аминогруппа повышает электронную плотность в ароматическом ядре, облегчая этим реакции электрофильного замещения. Вместо анилина можно использовать для этого опыта соли анилина. Они бромируются так же легко, как и сам анилин.
О П Ы Т № 9. ОБРАЗОВАНИЯ АЦЕТАНИЛИДА.
Выполнение работы.
Поиск по сайту: |











 NO2
NO2



 CH3
CH3
 NO2
NO2

 CH3 + HO-NO2 + Н2О
CH3 + HO-NO2 + Н2О

 CH3
CH3
 O2N
O2N NO2
NO2


 +HONO2 + H2O
+HONO2 + H2O
 NH2 OH
NH2 OH
 C=O + 2HOH → C=O (CO2+H 2O) + 2NH3
C=O + 2HOH → C=O (CO2+H 2O) + 2NH3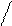
 NH2 NH 2·HNO3
NH2 NH 2·HNO3
 C=O + HNO3 → C=O
C=O + HNO3 → C=O NH2
NH2 C=O + 2HONO → 2N2 + CO2 + 3H2O |
C=O + 2HONO → 2N2 + CO2 + 3H2O |



 + H2SO4 SO4H-
+ H2SO4 SO4H-


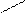

 NH3 +
NH3 +

 NH2
NH2 Сl- + NaOH + NaCl + H2O
Сl- + NaOH + NaCl + H2O




 + 3Вr2 + 3HBr
+ 3Вr2 + 3HBr