 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сделайте вывод о химических свойствах спиртов в сравнении с химическими свойствами фенолов и нафтолов.
Контрольные вопросы.
1. Напишите общую формулу гомологического ряда предельных одноатомных спиртов. 2. Сформулируйте правило Марковникова. 3. Составьте структурные формулы четырех изомерных спиртов, соответствующих формуле C 4H 10O. Назовите их по систематической номенклатуре. 4 . Составьте структурные формулы изомерных спиртов и простых эфиров, соответствующих формуле C 3H 8O. Назовите их. 5. Составьте уравнения реакций следующих превращений, используя структурные формулы органических веществ: а) метан → ацетилен → этилен → хлорэтан → этанол; б) этилен → этанол →хлорэтан →этилен →этан; в) карбид кальция → ацетилен → бензен → хлорбензен → фенол; г) этанол → хлорэтан → бутан →2-хлорбутан → бутанол-2. 6. Напишите уравнения химический реакций, при помощи которых бутанол-1 можно превратить в бутанол-2. 7. В чем заключается схожесть и отличие между одно- и многоатомными спиртами в реакциях дегидратации и окисления? 8. Как кислотные свойства фенолов зависят от электронодонорных и электроноакцепторных заместителей в ароматическом кольце и от их размещения относительно фенольного гидроксила?
Лабораторная работа №6. АЛЬДЕГИДЫ И КЕТОНЫ. Цель работы: изучение химических свойств альдегидов и кетонов.
Оборудование: пробирки, пипетки, газоотводные трубки, предметные и часовые стекла, спиртовки. Реактивы:
Методика проведения исследования: ОПЫТ 1. СВОЙСТВА ФОРМАЛЬДЕГИДА.
ЦВЕТНЫЕ РЕАКЦИИ: Выполнение работы.
а) С фуксинсернистой кислотой. В пробирку помещают 2 капли раствора фуксинсернистой кислоты и добавляют 2 капли раствора формальдегида. Раствор постепенно окрашивается в фиолетовый цвет. б) С резорцином. В пробирку наливают 10 капель раствора резорцина и 5 капель раствора формальдегида. Пипеткой осторожно по стенке добавляют 5-10 капель концентрированнойсерной кислоты. На границе двух жидкостейпоявляется малиновое кольцо. в) С нитропруссидом натрия. К 5 каплям раствора нитропруссида натрия прибавляют 1-2 капли формальдегида и две капли пиперидина. При встряхивании появляется темно-синее окрашивание.
г) РЕАКЦИЯ " СЕРЕБРЯНОГО ЗЕРКАЛА".
В пробирку вводят 2 капли раствора нитрата серебра и прибавляют каплю раствора аммиака. Образующийся бурый осадок гидроксида серебра растворяют, добавляя избыток 1-2 капли раствора аммиака. Затем прибавляют каплю раствора формальдегида и медленно подогревают содержимое пробирки над пламенем горелки. При осторожном нагревании содержимое пробирки буреет и на стенках может выделиться серебров виде блестящегозеркального налета. Альдегид окисляется до кислоты, котораяобразует аммониевую соль.
Химизм процесса:
HCOH + 2[Ag(NH3)2]OH → HCOONH4 + 2Ag + 3NH3 + HO
Эта реакция является качественнойреакцией на альдегиды.
д) ОКИСЛЕНИЕ ГИДРОКСИДОМ МЕДИ (II).
В пробирку помещают 4 капли раствора едкогонатра, разбавляют его с 4 каплями воды и добавляют 2 капли раствора сульфата меди. К выпавшему осадку гидроксида меди (II) прибавляют 1 каплю раствора формальдегида и взбалтывают содержимое пробирки. Нагревают над пламенем горелки до кипения. В пробирке выделяется желтый осадок гидроксида меди (I) CuOH, переходящий в красный оксид меди (I) Cu2O, а иногда на стенках пробирки выделяется даже металлическая медь. Химизм процесса:
HCOH + 2Cu(OH)2 → HCOOH + 2CuOH + H2O 2CuOH → Cu2O + H2O Эта реакция также является качественной реакцией на альдегиды. е) САМООКИСЛЕНИЕ (САМОВОССТАНОВЛЕНИЕ) ВОДНЫХ РАСТВОРОВ ФОРМАЛЬДЕГИДА.
В пробирку помещают 2-3 капли раствора формальдегида и добавляют 1 каплю индикатора метилового красного. Раствор принимает красную окраску, что указывает на кислую реакцию. Альдегиды очень легко окисляются. В водных растворах они могут окисляться в кислоту за счет кислорода другой молекулы альдегида, восстанавливая её в спирт - происходит реакция окислительного восстановления (дисмутация):
H OH OH OH
ж) ПОЛУЧЕНИЕ УРОТРОПИНА И ЕГО ГИДРОЛИЗ.
Впробирку помещают 1 каплю раствора фенолфталеина и 2 капли раствора аммиака. Раствор становитсярозовым; от прибавления 1 капли раствора формальдегида он обесцвечивается. Добавляют еще 2капли NH4OH - paствор становится розовым, но быстро обесцвечивается,так как аммиак вступает в реакцию с формальдегидом, образуягексаметилентетрамин, или уротропин. Добавляютпо каплям раствор аммиака до появления розового неисчезающего окрашивания, это указываетна то, что весь формальдегид прореагировал с аммиаком, и имеется избыток аммиака. Несколько капель полученного раствора переносят на предметное стекло и осторожно выпаривают воду над пламенем горелки. Нa стекле остаются кристаллы уротропина, они сладковатого вкусаи не имеют запаха. К оставшемусяв пробирке раствору уротропина добавляют каплю соляной кислоты и кипятят при встряхивании. Ощущаетсязапах формальдегида. В пробирку добавляют 2 капли раствора фуксинсернистой кислоты. Появляется розовое окрашивание, указывающее на присутствие формальдегида.
Химизм процесса:
уротропин
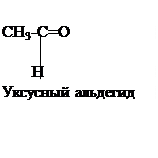
Реакция образования уротропина обратима,но гидролиз уротропина проходит только под влиянием катализатора - соляной кислоты, которая связываетобразующийся при гидролизе аммиак. ОПЫТ 2. ПОЛУЧЕНИЕ АЦЕТАЛЬДЕГИДА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ. Выполнение работы. а) ПОЛУЧЕНИЕ УКСУСНОГО АЛЬДЕГИДА.
В пробирку насыпают 0,5 г K2Cr2O7, приливают 10 капель 10 % серной кислоты и постепенно при встряхивании - 10 капель этилового спирта. Происходит разогревание смесии изменение её окраски. Пробирку закрывают пробкой с газоотводной изогнутой трубкой, конец которой опущен в пробирку-приемник с 2 мл воды. Приемникнаходится в стакане в ледяной водой. Осторожно нагревают пробирку в реакционной смесью и отгоняют летучие продукта в течение 2-3 мин. Часть полученного водного раствора, содержащего уксусный альдегид, используют дляпоследующих реакций.
Химизм процесса:
H
б) РЕАКЦИЯ ВОССТАНОВЛЕНИЯ АЛЬДЕГИДАМИ ФЕЛИНГОВОЙ ЖИДКОСТИ.
В пробирку наливают 10 капель реактиваФелинга и добавляют 3-4 капли уксусного альдегида. Реакционную смесьнагревают. При этом раствор сначала окрашивается взеленый, а затем в желтый цвет и,наконец, выпадает осадокзакиси меди красногоцвета. Химизм процесса:
в) ПОЛУЧЕНИЕ ФЕНИЛГИДРАЗОНА УКСУНОГО АЛЬДЕГИДА.
В пробирку помещают 5капель солянокислого фенилгидразина и добавляют несколькокристаллов уксуснокислого натрия. Затем при встряхивании прибавляют 4 капли уксусного альдегида. Выпадают кристаллы фенилгидразона. Химизм процесса:
H
г) ПОЛУЧЕНИЕ АЦЕТАЛЬДЕГИДА ИЗ АЦЕТИЛЕНА (по реакции КУЧЕРОВА).
Ацетилен получают действиемводы на карбид кальция. В пробирку или маленькую колбочку помещают несколько маленьких кусочков карбида кальция и закрывают её пробкой с двумяотверстиями, в одно из которыхвставлена капельная воронка, а в другое - изогнутая газоотводная трубка с оттянутым концом для подвода ацетиленав «реактор». «Реактор»-пробирку с газоотводной трубкой также закрывают пробкой, через которую почти до дна проходит трубка, подводящая ацетилен. Летучие продукты реакции уходят из реактора по отводной трубке в маленькую пробирку, охлаждаемую водой со снегом. В «реактор» помещают 0,1 г оксида ртути, 2 мл воды и 1 мл серной кислоты. Разогревшуюся смесь встряхивают, при этом большаячасть оксида ртути растворяется с образованием сульфата ртути:
После растворения оксида ртути “реактор” со смесью закрываю пробкой с трубкой, подводящей ацетилен, и помещают в водяную баню или в стакан с горячей водой (температура около 80-900С поддерживается на протяжениивсего опыта). В пробирку (колбочку) с карбидом медленно, по каплям, добавляют из капельной воронки воду. Создается ток газообразного ацетилена, интенсивность выделения которого должна быть такой, чтобы можно было считать пузырьки газа, проходящего через "реактор". Образовавший ацетилен, проходя в реакционной пробирке через раствор сернокислой ртути (катализатор), присоединяет воду с образованием уксусного альдегида. Через 8-10 минут прекращают пропускание ацетилена и разбирают прибор. Жидкость в приемнике имеет характерный запах уксусного альдегида.
Проверяютобразование уксусного альдегида цветнойреакцией с фуксинсернистой кислотой.
д) АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯ.
Помещают в пробирку 3 капли уксусного альдегида и 3 капли раствора едкого натра. Осторожно нагревают содержимое пробирки над пламенем горелки. Жидкость постепеннотемнеет и буреет, появляется резкий запах. Молекулы альдегидов могут соединяться друг с другом, образуя новые углеродные связи; происходит взаимодействие карбонильной группы одной молекулы альдегида с α-водородом метиловой группы другой молекулы. α -водород под влиянием соседней карбонильной группы способен отщеплятьсяв виде протона. Этареакция проходит под действием щелочей и образуетсякарбанион:
 H-C-CH+=O + OH- CH2-CH=O + H2O H-C-CH+=O + OH- CH2-CH=O + H2O
алкоголят-ион
Эта реакцияназывается альдольной конденсацией (реакцияА. П.Бородина). При нагревании реакционнойсмеси продуктдегидратируется:
Образующийся непредельный кротоновый альдегид (бутен-2-аль) имеет характерный резкий запах. При высокой концентрации щелочи процесс уплотнения идет дальше и образуются высокомолекулярные окрашенные смолистые продукты.
ОПЫТ 3. ПОЛУЧЕНИЕ АКРОЛЕИНА ИЗ ГЛИЦЕРИНА.
Выполнение работы.
Помещают в пробирку 2-3 кристаллика гидросульфата калия и добавляют 2 капли глицерина. Закрывают пробирку пробкой с газоотводной трубкой и нагревают на пламени горелки. Глицерин разлагается, доказательством чего является побурение жидкости и появление тяжелых паров. Не прекращая нагревание пробирки со смесью, опускают конец газоотводной трубки в заранее приготовленную пробирку с 2 каплями раствора фуксинсернистой кислоты. Появляется фиолетовое окрашивание. Образование акролеина обнаруживается также по появлению резкого запаха. Химизм процесса:
глицерин пропандиенол акролеин
При дегридатации трехатомного спирта - глицерина - в присутствии гидросуль-фата калия должен был бы образовываться непредельный спирт с двумя двойными связями - пропандиенол. Однако практически получается альдегид, так как в момент образования пропандиенол изомеризуется в альдегид - акролеин, который является простейшим непредельным альдегидом. Для доказательства непредельности акролеина, не прекращая подогревания пробирки со смесью, опускают конец газоотводной трубки в пробирку с 1 каплей раствора перманганата калия и 2 каплями воды, а потом в пробирку с 2 каплями бромной воды. Обесцвечивание растворов перманганата калия и бромной воды указывает нa наличие у акролеина свойств непредельных углеводородов.
ОПЫТ 4. СВОЙСТВА БЕНЗОЙНОГО АЛЬДЕГИДА. Выполнение работы.
а) РЕАКЦИЯ " СЕРЕБРЯНОГО ЗЕРКАЛА"
В пробирку вводят 2 капли раствора нитрата серебра и прибавляют 1 каплю растворааммиака. Образующийся бурыйосадок гидроксида серебра растворяют, добавляя избыток 1-2 капли раствора аммиака. Затем прибавляют 1 каплю бензойного альдегида иосторожно нагреваютсодержимое пробиркинад пламенем горелки - на стенках пробирки отлагается металлическое серебро.
Химизм процесса:
H
б) ОКИСЛЕНИЕ ГИДРОКСИДОМ МЕДИ.
Помещают в пробирку 3 капли раствора едкого натра, разбавляют его 3 каплями воды и добавляют2 каплираствора сульфата меди. К выпавшемуосадку гидроксида меди (II) Cu(OH)2прибавляют 1 каплю бензальдегида, взбалтывают содержимое пробирки и осторожно нагревают над пламенем горелки. Выделяется желтыйосадок гидроксида меди (I) CuOH, переходящийв красный оксид меди (I) Cu2O. Химизм процесса:
в) ОКИСЛЕНИЕ КИСЛОРОДОМ ВОЗДУХА.
Помещают на предметное стекло каплю бензойного альдегида и оставляют на воздухе. Через некоторое время появляются кристаллыбензойной кислоты, трудно растворимые в холоднойводе.
Химизм процесса:
Ароматические альдегиды окисляются еще легче,чем альдегидыжирного ряда, образуя соответствующиеароматические кислоты.Например, бензойный альдегид легче окисляетсядо бензойнойкислоты не только окислителями, но и кислородомвоздуха, особенно на свету. В качестве промежуточного продукта образуется перекисное соединение - надкислота. г) ВЗАИМОДЕЙСТВИЕ БЕНЗАЛЬДЕГИДА СО ЩЕЛОЧЬЮ (Реакция Канниццаро). В пробирку помещают 5капель бензойного альдегида и добавляют привстряхивании 3 каплираствора щелочи. Израствора выпадают кристаллы бензоата калия. Для ароматических альдегидов характерна реакция, заключающаяся в том, что под действием концентрированной щелочи две молекулы альдегида вступают друг с другом в окислительно-восстановительное взаимодействие: одна молекула окисляется в кислоту, другая восстанавливается в спирт. Эта реакция является частным случаем реакции сложноэфирной конденсации. Очевидно, вначале из двух молекул альдегида образуется сложный эфир, которыйв этих условиях под действием щелочи сразу же гидролизуется. Химизм процесса:
H O бензиловый спирт бензоат калия
Так как реакция протекает в щелочнойсреде, бензойная кислота получается в видесоли C6H5COOK. Содержимое пробирки переносят в центрифужную пробирку и центригфугируют около 5мин. Прозрачный раствор, содержащийбензиловый спирт, сливают в микрохимическую пробирку, добавляют 1 каплю серной кислоты и 2 капли раствора дихромата калия. Осторожно нагревают до кипения. Бензиловый спирт при этом окисляется, образуя бензойный альдегид и затем бензойную кислоту. Химизм процесса:
Бензиловый спирт H OH бензойный альдегид бензойная кислота
По помутнению содержимого пробирки можно судить об образовании бензойной кислоты.
ОПЫТ 5. ЦВЕТНАЯ РЕАКЦИЯ НА АЦЕТОН.
Выполнение работы. На предметное стекло наносят каплю раствора нитропруссида натрия, 2 капли воды и 1 каплю водного раствора ацетона. При добавлении капли раствора едкого натра смесь окрашивается в красный цвет, который от добавления 1 капли раствора уксусной кислоты принимает вишнево-красный оттенок.
Поиск по сайту: |
 AgNO3 + NH4OH AgOH + NH4NO3
AgNO3 + NH4OH AgOH + NH4NO3 2AgOH Ag2O + H2O
2AgOH Ag2O + H2O Ag2O + 4NH4OH 2[[Ag(NH3)2] OH + 3H2O
Ag2O + 4NH4OH 2[[Ag(NH3)2] OH + 3H2O CuSO4 + 2 NaOH Cu(OH)2 + Na 2SO4
CuSO4 + 2 NaOH Cu(OH)2 + Na 2SO4
 OH H
OH H

 4NH3 + 6CH2O C6H12N4 + 6H2O
4NH3 + 6CH2O C6H12N4 + 6H2O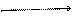
 3CH3-CH2OH + K2Cr2O7 + 4H2SO4 3CH3-C=O + K2SO4 + Cr2(SO4)3 + 7H2O
3CH3-CH2OH + K2Cr2O7 + 4H2SO4 3CH3-C=O + K2SO4 + Cr2(SO4)3 + 7H2O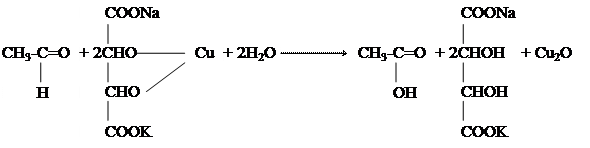
 C6H5NH-NH2*HCl + CH3COONa C6H5-NH-NH2 + CH3COOH + NaCl
C6H5NH-NH2*HCl + CH3COONa C6H5-NH-NH2 + CH3COOH + NaCl



 CH3-C= O + H2 N-NH-C6H5 CH3-CH=N-NH-C6H5 + H2O
CH3-C= O + H2 N-NH-C6H5 CH3-CH=N-NH-C6H5 + H2O
 HgO + H2SO4 HgSO4 + H2O
HgO + H2SO4 HgSO4 + H2O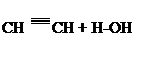

 H
H

 CH3-CH+ + :CH2—CH=O CH3-CH-CH2-CH=O
CH3-CH+ + :CH2—CH=O CH3-CH-CH2-CH=O

 CH2OH-CHOH-CH2OH CH2=C=CHOH CH2=CH-C=O + H2O
CH2OH-CHOH-CH2OH CH2=C=CHOH CH2=CH-C=O + H2O
 C6H5-C=O + 2Cu(OH)2 C6H5-C=O + 2CuOH +H2O
C6H5-C=O + 2Cu(OH)2 C6H5-C=O + 2CuOH +H2O

 2CuOH Cu2O + H2O
2CuOH Cu2O + H2O


 2C6H5-C=O + KOH C6H5-C-OK + C6H5-CH2OH
2C6H5-C=O + KOH C6H5-C-OK + C6H5-CH2OH
