|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Скорочувальна функція.
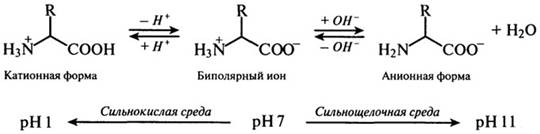
Актин та міозин – специфічні білки м’язової тканини, що забезпечують скорочення м’язів. Білки побудовані з L-амінокислот Амінокислоти –органічні карбонові кислоти,в молекулах яких один або декілька атомів водню заміщені аміногрупою. – Усі амінокислоти, що входять до складу білків, є α-амінокислотами, оскільки їх аміногрупа перебуває у α-положенні, тобто поряд з карбоксильною групою. – Усі амінокислоти, за винятком гліцину, мають асиметричний атом вуглецю (тобто атом вуглецю з чотирма різними замісниками) і тому є оптично активними сполуками. Амінокислоти, що містяться в білках, належать до L-ряду. L-конфігурація – аміногрупа розташована зліва, D-конфігурація – аміногрупа розташована справа. – Деякі амінокислоти L- ряду (пролін, валін, серин, треонін) мають солодкий смак і використовуються в якості цукрозамінників в харчуванні діабетиків. L-глютамінова кислота має смак м‘яса. – Амінокислоти – амфотерні електроліти, оскільки аміногрупа має основні властивості, а карбоксильна – кислотні. У водних розчинах в інтервалі рН 4-9 амінокислоти існують переважно у вигляді біполярних іонів, які називаються цвітер-йонами.
– За хімічною будовою: аліфатичні, гетероциклічні, ароматичні У живих організмах нараховується 21 протеїногенна амінокислота. Скорочено амінокислоти позначають трьома літерами або однією літерою. Ala (A), Arg(R). У нейтральних розчинах усі амінокислоти йонізовані, існують у вигляді цвітер-йонів. – Вищі рослини та більшість мікроорганізмів синтезують усі 20 амінокислот. Амінокислоти можна поділити на три групи. Перші – синтезуються в організмі, називаються замінними; другі – в недостатній кількості синтезуються в організмі – напівзамінні; треті – надходять з їжею - незамінні (8: Bal, Leu, Ile, Phe, Trp, Thr, Lys, Met). Замінні амінокислоти здатні замінювати одна іншу в раціоні, так як вони перетворюються одна в одну або синтезуються з проміжних продуктів вуглеводного або ліпідного обміну. Відсутність в їжі хоча б однієї незамінної амінокислоти викликає негативний азотистий баланс, порушення діяльності центральної нервової системи, зупинку росту і важкі клінічні наслідки типу авітамінозу. Недостатня кількість однієї незамінної амінокислоти призводить до неповного засвоєнню інших. Дана закономірність підкоряється закону Лібіха, за яким розвиток живих організмів визначається тією незамінною речовиною, яка присутня в найменшій кількості. Залежність функціонування організму від кількості незамінних амінокислот використовується при визначенні біологічної цінності білків хімічними методами. Найбільш широко використовується метод X. Мітчела і Р. Блоку (Mitchell, Block, 1946), відповідно до якого розраховується показник амінокислотного скора (а.с.). Скор виражають у відсотках або безрозмірною величиною, що представляє собою відношення вмісту незамінної амінокислоти (А.К.) в досліджуваному білку до її кількості в еталонному білку. При розрахунку скора (у%) формула виглядає наступним чином:
Амінокислотний склад еталонного білка збалансований і ідеально відповідає потребам організму людини в кожній незамінній кислоті, тому його ще називають "ідеальним". Амінокислота, скор якої має найнижче значення, називається першою лімітуючою амінокислотою. Значення скора цієї амінокислоти визначає біологічну цінність і ступінь засвоєння білків. А.С. курячого яйця-1, коров‘ячого молока-0,95, рис 0,67 соя-0,55, пшениця-0,53. Зазвичай розраховують скор для трьох найбільш дефіцитних а.к.: лізин, метіонін, триптофан 3:3:1. Співвідношення суми незамінних а.к.до суми замінних не повинно бути нижчим 0,4. Класифікація амінокислот, що входять до складу білків, за принципом полярності (неполярності) радикала (бічного ланцюга). 1. Неполярні або гідрофобні радикали. Аліфатичні – аланін, валін, лейцин, ізолейцин. Містять атом Сульфуру – метіонін. Ароматична – фенілаланін. Гетероциклічна – триптофан. Імінокислота – пролін.
Аланін Валін Лейцин
Ізолейцин Метіонін
Фенілаланін Триптофан Пролін
2. Полярні, незаряджені радикали. Гліцин. Гідроксамінокислоти – серин, треонін, тирозин. Містить сульфгідрильну группу – цистеїн. Містять амідну группу – аспарагін, глутамін.
Гліцин Серин Треонін
Цистеїн Аспарагін Глутамін
3. Негативно заряджені радикали. Аспарагінова кислота, глютамінова кислота.
Аспарагінова кислота Глютамінова кислота
4. Позитивно заряджені радикали. Лізин, аргінін, гістидин.
Лізин Аргінін Гістидин З амінокислот будуються пептиди та білки. Цей процес нагадує нанизування бусинок на нитку. При цьому можливі самі різні сполучення амінокислот. Послідовність амінокислот у «намисті» називається первинною структурою білка. Оскільки намистинкою може бути кожна з 21 амінокислоти, то навіть для коротких білків існує величезна кількість можливих варіантів первинної структури. Наприклад, існує більш 10 трильйонів (трильйон-1012) варіантів зібрати білок довжиною усього в 10 амінокислот! Після того як визначена первинна структура білка, під дією електростатичних взаємодій між різними бічними групами амінокислот, а також між амінокислотами і навколишньою водою, білок приймає складну тривимірну форму. Способи добування амінокислот: Гідроліз білків – кислотний, лужний, ферментативний Хімічний синтез потім розділення рацемату (суміш L- i D-форми) за допомогою іммобілізованих ферментів. Мікробіологічний синтез: триптофан, лізин Майже всі α-амінокислоти, що надходять з травного тракту людини в кров'яне русло організму, зазнають ряд загальних перетворень, призначення яких полягає в забезпеченні пластичним матеріалом процесу синтезу білків і пептидів та здійсненні дихання з утворенням АТФ (рис.). В основі таких перетворень лежать реакції дезамінування, трансамінування та декарбоксилю-вання.
БУДОВА БІЛКІВ Способи зв¢язку амінокислот у молекулі білку. 1. Ковалентні зв’язки у молекулі білка можуть бути двох типів – пептидні та дисульфідні. Наявність у білках кетоімідного типу зв'язку, який був названий пептидним. Пептидний зв'язок утворюється внаслідок взаємодії карбоксильної групи однієї амінокислоти з аміногрупою другої амінокислоти. Сполуки, які при цьому утворюються, називаються пептидами. Схематично процес можна показати так:
АланінВалін Дипептид (аланіл-валін) Дослідженнями встановлено, що пептидний зв'язок є проміжним між подвійним і простим (одинарним) зв'язком. Так відстань між атомами вуглецю і азоту (С—N) в пептидному зв'язку дорівнює 0,132 нм, тоді як довжина одинарного зв'язку між вуглецем і азотом становить 0,147 нм, а подвійного — 0,125 нм. Ця особливість пептидного зв'язку зумовлює таутомерне (кетоенольне) перетворення:
Необхідно зауважити, що обертання навколо пептидного зв'язку значною мірою загальмовано порівняно з іншими зв'язками (N—С–a, С—С–a), які утворюють скелет поліпептидного ланцюга. Пептидний зв'язок є досить жорстким і має плоску транс конфігурацію. Він є основою утворення поліпептидних ланцюгів, з яких побудовано молекули білка. Ковалентні зв'язки між залишками двох цистеїнів (дисульфідні містки). Цей досить міцний ковалентний зв'язок утворюється внаслідок відщеплення атомів водню від сульфгідрильних груп двох амінокислотних залишків цистеїну. Дисульфідний зв'язок, як і водневий, може бути внутрішньоланцюговим (а) і міжланцюговим (б). Велика кількість дисульфідних зв'язків є також в білках сполучної і покривної тканин та в білках, які мають високу біологічну активність. Дисульфідні зв'язки мають важливе значення в формуванні третинної структури білків. Руйнування цих зв'язків призводить до дестабілізації даного рівня структури і втрати білком його біологічної активності. 2. Іонні (електростатичні) взаємодії між протилежно зарядженими амінокислотними залишками (три радикали зі знаком «+» і два зі знаком «-»). Між залишками моноамінодикарбоновими та діаміномонокарбоновими кислотами. Наприклад, позитивно заряджена e-аміногруппа лізину (–NН3+) притягається негативно зарядженою карбоксильною групою – (–СОО–) глютамінової або аспарагінової кислоти. Виникає електростатична взаємодія. Приймають участь в утворенні третинної та четвертинної структури.
Залишок глютамінової кислоти
Залишок лізину 3. Водневі зв'язки – слабке електростатичне притягнення між одним електронегативним атомом (наприклад, киснем чи азотом) та водневим атомом, що ковалентно-зв'язаний з другим електронегативним атомом. Беруть участь всі амінокислоти, що у радикалі мають гідроксильні, амідні або карбоксильні групи.У молекулах білка водневий зв'язок найчастіше утворюється при взаємодії атома водню імінної групи залишку однієї амінокислоти з атомами кисню карбонільної групи залишку іншої амінокислоти:
Водневий зв'язок у молекулі білка може бути внутрішньоланцюговим (з’єднує окремі витки однієї спіралі) і міжланцюговим (з’єднує різні поліпептидні ланцюги). У нативних білках цей тип зв'язку може утворюватися не лише між воднем і киснем пептидних груп, а й між іншими функціональними групами поліпептидного ланцюга. Водневий зв’язок досить слабкий. Грає важливу роль в утворенні вторинної, третинної та четвертинної структур.
Між атомом Гідрогену гідроксильної групи і атомом Оксисену карбонільної групи пептидного зв’язку.
Між атомом Оксисену і атомом Гідрогену двох гідроксильних груп або гідроксильної та аміногруп. 4. Гідрофобні взаємодії. Утворюються внаслідок міжмолекулярної взаємодії (сил Ван- дер Ваальса) між неполярними алкільними радикалами у водному середовищі.
Залишок лейцину
Залишок валіну
Перш ніж розглянути природу гідрофобних взаємодій, необхідно ввести поняття гідрофобних (і гідрофільних) функціональних груп і сполук. Самі назви вказують на те, що ці поняття відносяться до водних розчинів. Групи, що можуть утворювати водневі зв'язки з молекулами води, називаються гідрофільними. Оскільки молекула води може виступати як у ролі донора атома Гідрогену, так і в ролі акцептора атома Гідрогену, гідрофільними є групи, що мають або «кислий» атом Гідрогену (атом Гідрогену, з'єднаний з атомом, більш електронегативним, чим атом Карбону), або атоми з неподіленою електронною парою. До таких груп відносяться гідрокси- і аміногрупи, карбонільна, карбоксильна, амідна групи і т.п. Молекули або частини молекули, які не здатні утворювати водневі зв'язки з водою називаються гідрофобними. До гідрофобних груп відносяться алкільні й ароматичні радикали. Як правило, гідрофобні сполуки – або погано, або зовсім нерозчинні, гідрофільні добре розчинні у воді. Грає важливу роль в стабілізації третинної та четвертинної структур. Особливо важливим є дослідження послідовності розміщення залишків амінокислот у поліпептидних ланцюгах, тобто первинної структури білка. Остання визначає трьохмірну структуру поліпептидних ланцюгів, яка називається конформацією білка.
Поиск по сайту: |


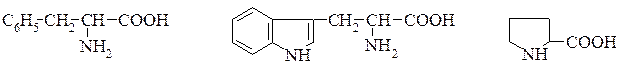


 Тирозин
Тирозин
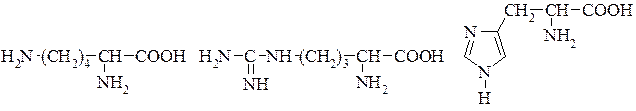
 Рис. Основні функції амінокислот в організмі
Рис. Основні функції амінокислот в організмі