 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
УРАВНЕНИЕ ШРЕДИНГЕРА ДЛЯ ЭЛЕКТРОНА В КУЛОНОВСКОМ ПОЛЕ ЯДРА.
Рассмотрим уравнение Шредингера для электрона в кулоновском поле ядра атома водорода. Водород – простейший атом, состоящий из ядра и одного электрона. Масса ядра водорода значительно (примерно в 1840 раз) превосходит массу электрона, поэтому в первом приближении ядро можно считать неподвижным и рассматривать движение электрона вокруг этого неподвижного ядра. Между ядром и электроном действует сила кулоновского притяжения. Кулоновское поле ядра, в котором движется электрон, представляет собой поле точечного заряда, т.е. является центрально-симметричным полем, в котором потенциальная энергия U зависит только от расстояния до центра поля. Поэтому при решении уравнения Шредингера оператор Лапласа
Ищем решение (9) в виде:
где
Это равенство верно при выполнении двух условий:
Следовательно:
Последнее выражение совпадает с первым Боровским радиусом
Это значение энергии основного состояния атома водорода, соответствующее n = 1. Сравнивая полученный результат с формулой (7) для энергии в атоме водорода, полученной по теории Бора, увидим, что теория Бора дает такие же значения Уравнение Шредингера имеет решения при любых положительных значениях энергии (Е > 0) и при дискретных отрицательных значении энергии (Е < 0). Для любых квантовых чисел n энергия определяется:
Случай Е > 0 соответствует электрону, который из бесконечности подлетает к ядру и снова удаляется от него в бесконечность. То есть, в случае Е > 0 уравнение описывает процесс рассеивания электрона на ядре. Случай Е < 0 соответствует электрону, связанному с ядром (рис 5). Формула для энергии электрона в атоме водорода (10) совпадает с формулой (7), полученной по теории Бора. Но этот результат получен в квантовой механике в результате решения основного уравнения, в то время как Бору пришлось вводить специальные допущения. Таким образом, дискретность энергетических уровней энергии электрона в атоме водорода является квантово-механической закономерностью.
Поиск по сайту: |
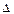 обычно записывают в сферической системе координат r,
обычно записывают в сферической системе координат r, 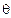 ,
,  и волновую функцию электрона Ψ получают как функцию этих координат.
и волновую функцию электрона Ψ получают как функцию этих координат.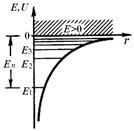 Потенциальная энергия электрона в кулоновском поле ядра равна
Потенциальная энергия электрона в кулоновском поле ядра равна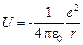 ,
, где r – расстояние от электрона до ядра. Волновая функция электрона в основном состоянии является функцией только r. Уравнение Шредингера для основного состояния атома водорода имеет вид:
где r – расстояние от электрона до ядра. Волновая функция электрона в основном состоянии является функцией только r. Уравнение Шредингера для основного состояния атома водорода имеет вид: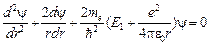 . (9)
. (9)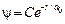 .
.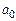 имеет размерность длины; С – некоторая постоянная, определяемая из условия нормировки вероятности. Подставим функцию
имеет размерность длины; С – некоторая постоянная, определяемая из условия нормировки вероятности. Подставим функцию 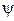 и продифференцируем по r. Тогда получим:
и продифференцируем по r. Тогда получим: .
.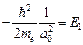 , (*)
, (*)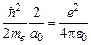 .
.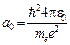 .
.
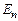 , как и квантовая механика. Однако в рамках квантовой механики этот результат появляется как результат решения основного уравнения для частного случая, в то время как Бор вынужден был ввести для этого частного случая специальные предположения. Для квантового числа n, нумерующего уровни, сохранилось название главного квантового числа.
, как и квантовая механика. Однако в рамках квантовой механики этот результат появляется как результат решения основного уравнения для частного случая, в то время как Бор вынужден был ввести для этого частного случая специальные предположения. Для квантового числа n, нумерующего уровни, сохранилось название главного квантового числа.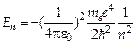 (10)
(10)