 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Вопрос № 1. Химические и физические процессы, протекающие при горении (55 мин.)Стр 1 из 5Следующая ⇒
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ по дисциплине "ХИМИЯ ПРОЦЕССОВ ГОРЕНИЯ" Для специальности 280705.65 – пожарная безопасность СМК-УМК 4.4.2-40-2013 Тема 1.: Физико-химическая природа процессов горения
Занятие № 1.2: Основные характеристики процессов горения (4 час.)
ОСНОВНАЯ ЧАСТЬ (155 мин.) Вопрос № 1. Химические и физические процессы, протекающие при горении (55 мин.)
(Повторение лекционного материала). В пламени одновременно протекают химические и физические процессы, между которыми существуют определенные причинно-следственные связи. К химическим процессам в пламени относятся: на подходе к зоне горения: - термическое разложение исходных веществ с образованием более легких продуктов (водорода, оксидов углерода, простейших углеводородов, воды и т.д.); во фронте пламени: - термоокислительные превращения с выделением теплоты и образованием продуктов полного (диоксида углерода и воды) и неполного горения (оксида углерода, сажи, копоти, смол и др.); - диссоциация продуктов горения, - ионизация продуктов горения. К физическим процессам в пламени относятся: - тепломассоперенос во фронте пламени; - процессы, связанные с испарением и доставкой летучих горючих веществ в зону горения. Скорость переноса (диффузии) веществ имеет решающее значение, например, в неоднородных системах, где она гораздо меньше скорости химических реакций окисления. Соотношение скорости химических превращений и физических процессов определяет режим процесса горения. Полное время горения tг, складывается из длительности физических и химических процессов:
Кинетический режим горения характеризуется длительностью tг » tх, поскольку в этом случае физических процессов подготовки (перемешивания) не требуется, т.е. tф » 0 Диффузионный режим горения, наоборот, зависит в основном от скорости подготовки однородной горючей смеси, т.е. длительность его tг » tф. В этом случае tф >> tх, и поэтому последним можно пренебречь. Если tф » tх, т.е. они соизмеримы, то горение протекает в так называемой промежуточной области.
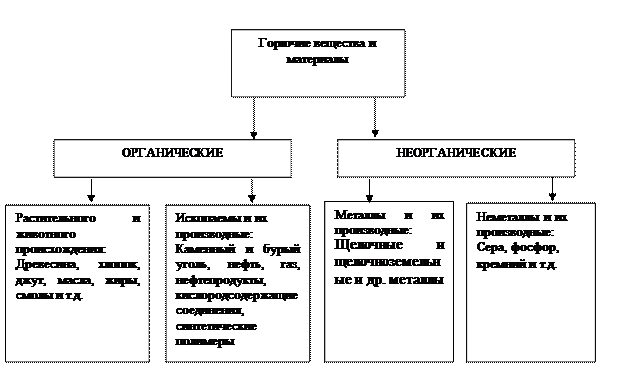
Вспомним, что для процесса горения необходимы горючее вещество, окислитель и источник тепла (зажигания). Горючие вещества и материалы классифицируют по химической природе, происхождению, агрегатному состоянию, дисперсности и т.д. По химической природе горючие вещества и материалы подразделяются на два основных класса: органические и неорганические (рис.1.). Такое подразделение весьма условно, поскольку многие органические вещества содержат как в химически связанном, так и в виде примесей неорганические компоненты, нелетучая часть которых остается в виде золы, шлаков и.т.п. Органические горючие вещества – это все вещества на основе углерода, представляющие собой материалы растительного и животного происхождения, или же ископаемые вещества, т.е. добываемые из недр земли. Все они применяются как в натуральном виде, так и после соответствующей обработки. Неорганические горючие вещества и материалы представляют собой все простые и сложные вещества неорганической природы, способные к реакциям горения. По современной химической классификации это металлы и неметаллы, их различные производные. К горючим металлам и их производным относятся все щелочные и щелочноземельные металлы, а также металлы других групп периодической системы Д.И. Менделеева и их производные - карбиды, сульфиды и т.п. К горючим неметаллам и их производным относятся бор, кремний, фосфор, мышьяк, сера, селен, теллур, их карбиды, гидриды, сульфиды и т.д. По агрегатному состоянию горючие вещества и материалы подразделяются на газообразные, жидкие и твердые.
Рис. 1. Классификация горючих веществ и материалов.
Все индивидуальные вещества могут быть охарактеризованы коэффициентом горючести. Коэффициент горючести К является безразмерным коэффициентом и служит для определения горючести вещества. Рассчитанный коэффициент горючести может быть использован для приближенного вычисления температуры вспышки вещества, а также величины нижнего концентрационного коэффициента распространения пламени. Коэффициент горючести рассчитывается по следующей формуле:
n(C), n(S), n(H), n(N), n(O), 2 n(Cl), n(F), n(Br) – число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора и брома в молекуле вещества. Если коэффициент горючести К больше единицы (К ³ 1), то вещество является горючим; при значении К меньше единицы (К < 1) – вещество негорючее.
Решение: 1. В молекуле анилина n(C) = 6; n(Н) = 7; n(N) = 1; К = 4 × 6 + 7 + 1 = 32 К > 1, следовательно, анилин – горючее вещество.
2. В молекуле хлорной кислоты n(Н) = 1; n(Cl) = 1; n(О) = 4; К = 1 – 2 × 4 – 2 × 1 = - 9 К < 1, хлорная кислота – негорючее вещество.
Окислители - это вещества, атомы которых в химических превращениях принимают электроны. Среди простых веществ к ним относятся все галогены и кислород. Наиболее распространенным в природе окислителем является кислород воздуха. Именно ему человечество обязано широким распространением пожаров на Земле. Воздух содержит 21 % по объему кислорода и 79 % азота. На один объем (моль) кислорода в воздухе приходится 79/21 = 3,76 объема (моля) азота, который не вступает в реакции горения. Однако его приходится учитывать при составлении уравнения материального и теплового баланса процессов горения, поскольку часть теплоты расходуется на его нагревание. Горение в воздухе - основной процесс на пожаре, однако во многих технологических процессах используется воздух, обогащенный кислородом, и даже чистый кислород (например, металлургические производства, газовая сварка, резка и т.д.). С атмосферой, обогащенной кислородом, можно встретиться в подводных и космических аппаратах, доменных процессах и т.д. Такие горючие системы имеют повышенную пожарную опасность. Это необходимо учитывать при разработке систем пожаротушения, пожарно-профилактических мероприятий и при пожарно-технической экспертизе пожаров. Помимо кислорода воздуха и галогенов окислителями в реакциях горения могут выступать и сложные вещества, например, соли кислородсодержащих кислот - нитраты, хлораты и т.п., применяемые в производстве порохов, боевых и промышленных взрывчатых веществ и различных пиротехнических составов.
Состав продуктов горения зависит от состава исходного вещества.
Решение : Составление реакций горения веществ в воздухе аналогично составлению реакций горения в кислороде. Особенность состоит только в том, что азот воздуха при температуре горения ниже 20000С в реакцию горения не вступает и выделяется из зоны горения вместе с продуктами горения.
Горение водорода в воздухе Н2 + 0,5(О2 + 3,76N2) = Н2О + 0,5×3,76N2 b = 0,5. Обратите внимание, что стехиометрический коэффициент перед кислородом b = 0,5 необходимо поставить и в правой части уравнения перед азотом.
Горение пропанола в воздухе С3Н7ОН + 4,5(О2 + 3,76N2) =3СО2 + 4Н2О +4,5×3,76N2 b = 4,5. В составе горючего есть кислород, поэтому расчет коэффициента b проводят следующим образом: 10 – 1 = 9; 9 : 2 = 4,5.
Горение анилина в воздухе С6Н5NН2 + 7,75(О2 + 3,76N2) =6СО2 + 3,5Н2О + 0,5N2 +7,75×3,76N2 b = 7,75. В этом уравнении азот в правой части уравнения встречается дважды: азот воздуха и азот из горючего вещества. Горение угарного газа в воздухе СО + 0,5(О2 + 3,76N2) =СО2 + 0,5×3,76N2 b = 0,5. Горение хлорметана в воздухе СН3Сl + 1,5(О2 + 3,76N2) =СО2 + НСl + Н2О +1,5×3,76N2 b = 1,5.
Горение диэтилтиоэфира в воздухе (С2Н5)2 S + 7,5(О2 + 3,76N2) =4СО2 + 5Н2О + SO2 + 7,5×3,76N2 b = 7,5. Горение диметилфосфата в воздухе (СН3)2НР О4 + 3(О2 + 3,76N2) =2СО2 + 3,5Н2О + 0,5Р2О5 + 3×3,76N2 b = 3.
В процессах горения исходными веществами являются горючее вещество и окислитель, а конечными - продукты горения.
Поиск по сайту: |
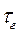 =
= 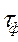 +
+ 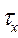
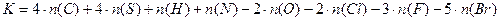 где:
где: