 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Гальванический элемент ⇐ ПредыдущаяСтр 4 из 4
Если полуреакции окисления и восстановления проводить в разных сосудах, соединив электроды по которому от электрода, на котором протекает процесс окисления, электроны будут перемещаться к электроду, на котором протекает восстановительный процесс. Для передвижения ионов из одного раствора в другой соединим оба раствора трубкой, наполненной раствором электролита. Такая система называется гальваническим элементом, химическим источником тока или электрохимической ячейкой. Это устройство, которое позволяет превратить энергию окислительно-восстановительной реакции в электрическую. Электрод, на котором протекает процесс окисления называется анодом. Восстановление протекает на электроде называемым катодом. Прибор для измерения потенциала окислительно восстановительной системы представляет собой гальванический элемент, в котором одним электродом является стандартный водородный, а вторым – электрод, потенциал которого измеряется. По существу измеряется разность потенциалов двух электродов. Так как потенциал стандартного водородного принят равным нулю, эта разность (э.д.с.) соответствует значению потенциала измеряемого электрода. Разность потенциалов анода и катода называется электродвижущей силой гальванического элемента (э.д.с.) и измеряется в Вольтах (В): ε = φк – φа Если окислительно-восстановительная реакция осуществляется в стандартных условиях, т.е., если все вещества, участвующие в реакции, находятся в стандартных состояниях, то наблюдаемая при этом э.д.с. называется стандартной электродвижущей силой ε0 данного элемента. Она, очевидно, равна: ε0 = φ0к – φ0а Из двух электродов гальванического элемента катодом будет тот, потенциал которого больше, анодом – электрод с меньшим потенциалом, т.е.: φ0к > φ0а При схематическом изображении цепи водородный электрод всегда записывают слева; напр., потенциал медного электрода в растворе соли меди равен эдс цепи Pt, H2|HCl||CuCl2|Cu|Pt (две штриховые черты означают, что диффузионный потенциал на границе НС1 и СuС12 устранен). Рассмотрим медно-цинковый химический источник тока (ХИТ). Схема медно-цинкового гальванического элемента:
(-) А [Zn/Zn(SO4)2||KCl|Cu/Cu(SO4)2] K (+).
Процесс на аноде (А): Zn0 – 2е = Zn2+ окисление Процесс на катоде (К): Cu2+ + 2е = Cu0 восстановление
Солевой мостик с раствором KCl, соединяющий два сосуда, необходим для того, чтобы в область катода поступали катионы (K+,Zn2+), так как их недостаток возникает из-за восстановления катионов меди. В область анода поступают анионы (Cl-, SO42-), так как из-за образования новых катионов цинка возникает избыток положительного и недостаток отрицательного заряда. Происходит выравнивания количества положительно и отрицательно заряженных частиц. Общее выражение окислительно-восстановительного процесса: Zn0 + Cu2+= Zn2+ + Cu0 Для того, чтобы установить какой электрод будет катодом, а какой анодом, необходимо рассчитать значения электродных потенциалов по уравнению Нернста.
Величина электродного потенциала полуреакции восстановления вычисляется по уравнению Нернста: Е = Е0 + Для медного электрода: Е = Е0 + Для цинкового: Е = Е0 + Если молярная концентрация катионов цинка и меди равна единице, потенциалы электродов будут равны стандартным: Е0Zn2+/Zn = -0,763B, E0Cu2+/Cu = 0,337B. Так как потенциал медного электрода больше, он будет катодом, а цинковый электрод – анодом. Стандартная э.д.с. (ε0) гальванического элемента связана со стандартной энергией Гиббса ΔrG0, протекающей в элементе реакции соотношением: zFε0 = - ΔrG0, где z – число электронов, принимающих участие в реакции, F0 – постоянная Фарадея. С другой стороны, ΔrG0 связана с константой равновесия К реакции уравнением: ΔrG0 = -2,3RT∙lgK Из двух последних уравнений следует: zFε0 = 2,3RT∙lgK Тогда константа равновесия будет равна: K = 10zFε0/2,3RT = 10zFε0/0,059 Из уравнения zFε0 = - ΔrG0 можно сделать вывод о направлении протекания окислительно-восстановительной реакции. - Так как реакция может самопроизвольно протекать в прямом направлении, если ΔrG0 <0, т.е. zFε0 >0, значит ε0 >0. Так как: ε0 = φ0к – φ0а, то реакция будет протекать в направлении соответствующем неравенству: φ0к – φ0а >0 или φ0к > φ0а . - При ΔG°298 >> 0 и, следовательно, (φ°Ок - φ°Вс) << 0 , реакции в прямом направлении протекать не будут, то термодинамически возможными становятся обратные реакции. Реакция будет протекать в том направлении, в котором пара окисленная-восстановленная форма, имеющая большее значение стандартного потенциала, будет восстанавливаться. Например, в каком направлении в стандартных условиях будет протекать реакция (Mn2+ - восстановитель, I2 - окислитель): 2 Mn2+ + 8 H2O + 5 I2 = 2 MnO4- + 16 H+ + 10 I- В приведенном примере: φ °Ок - φ °Вс = φ ° (MnO4- / Mn2+) - φ ° (I2/ I-) = + 0,535 - (+ 1,531) = - 0,996 В в прямом направлении не протекает, но хорошо идет обратная реакция - восстановление перманганат-ионов с помощью иодид-ионов в кислой среде: 2 MnO4- + 16 H+ + 10 I- = 2 Mn2+ + 8 H2O + 5 I2 φ °Ок - φ °Вс = + 1,531 - (+ 0,535) = + 0,996 В На практике считается, что если разность (φ°Ок - φ°Вс) >> + 0,4 В, то реакция окисления-восстановления протекает до конца (т.е. с высоким выходом, порядка 99,0 – 99,9%). Это означает, что реагенты проявляют сильные окислительные и восстановительные свойства соответственно. Часто для практически полного проведения реакции при большом положительном значении разности (φ°Ок - φ°Вс) достаточно взять сильный восстановитель или сильный окислитель. Если разность (φ°Ок - φ°Вс) лежит в пределах (-0,4) ÷ (+0,4)В, то в стандартных условиях реакция будет протекать в малой степени. Это обратимая окислительно-восстановительная реакция. Для практического проведения таких реакций отходят от стандартных условий и применяют концентрированные растворы окислителей и восстановителей (при этом берут большой избыток окислителя или восстановителя, а если это возможно, один из реагентов - в виде твердого вещества или газа). В таких случаях потенциал окислителя увеличивается, а потенциал восстановителя уменьшается, что приводит к росту значения (φ°Ок - φ°Вс). Кроме того, повышению степени протекания реакций способствует нагревание реакционной смеси. Обратимые химические реакции используют в заряжаемых ХИТ (аккумуляторах), необратимые – в батарейках.
Решение типовых задач Задача 1. Напишите уравнение реакции окисления дисульфида железа (II) концентрированной азотной кислотой. Составьте: схемы электронного и электронно-ионного баланса. Fe2O3 + CO → Fe + CO2 Решение: Fe2O3 + 3 CO = 2 Fe +3 CO2 Fe2III + 6 e- = 2Fe0 1 CII - 2 e- = CIV 3 При одновременном окислении (или восстановлении) атомов двух элементов одного вещества расчет ведут на одну формульную единицу этого вещества. Пример 3. Подберите коэффициенты в уравнении окислительно-восстановительной реакции методом электронного баланса. Fe(S)2 + O2 = Fe2O3 + SO2 Решение: 4 Fe(S)2 + 11 O2 = 2 Fe2O3 + 8 SO2 FeII - e- = FeIII 2S-I - 10 e- = 2SIV -11e- 4 O20 + 4 e- = 2O-II + 4 e- 11 Пример 4. Подберите коэффициенты в уравнении реакции внутримолекулярного окисления-восстановления (NH4)2CrO4 → Cr2O3 + N2 +H2O + NH3 Решение 2 (NH4)2CrO4 = Cr2O3 + N2 +5 H2O + 2 NH3 CrVI + 3 e- = CrIII 2 2N-III - 6 e- = N20 1 Для реакций дисмутации (диспропорционирования, самоокисления - самовосстановления), в которых атомы одного и того же элемента в реагенте окисляются и восстанавливаются, дополнительные множители проставляют вначале в правую часть уравнения, а затем находят коэффициент для реагента. Пример 5. Подберите коэффициенты в уравнении реакции дисмутации H2O2 → H2O + O2 Решение 2 H2O2 = 2 H2O + O2 O-I + e- = O-II 2 2O-I - 2 e- = O20 1 Для реакции конмутации (синпропорционирования), в которых атомы одного и того же элемента разных реагентов в результате их окисления и восстановления получают одинаковую степень окисления, дополнительные множители проставляют вначале в левую часть уравнения. Пример 6. Подберите коэффициенты в уравнении реакции конмутации: H2S + SO2 → S + H2O Решение 2 H2S + SO2 = 3 S + H2O S-II - 2 e- = S0 2 SIV + 4 e- = S0 1 Закончить уравнение реакции и подобрать коэффициенты методом ионно-электронного баланса K2Cr2O7 + H2SO4 + H2S → Метод подбора коэффициентов с помощью электронно-ионного баланса складывается из следующих этапов: а) записывают формулы реагентов данной окислительно-восстановительной реакциии устанавливают химическую функцию каждого из них (здесь K2Cr2O7 - окислитель, H2SO4 - кислотная среда реакции, H2S - восстановитель); б) записывают (на следующей строчке) формулы реагентов в ионном виде, указывая только те ионы (для сильных электролитов), молекулы (для слабых электролитов и газов) и формульные единицы (для твердых веществ), которые примут участие в реакции в качестве окислителя (Cr2O72-), среды (Н+ - точнее, катиона оксония H3O+) и восстановителя (H2S): Cr2O72- + H+ + H2S в) определяют восстановленную формулу окислителя и окисленную форму восстановителя, что должно быть известно или задано (так, здесь дихромат-ион переходит катионы хрома(III), а сероводород - в серу); эти данные записывают на следующих двух строчках, составляют электронно-ионные уравнения полуреакций восстановления и окисления и подбирают дополнительные множители для уравнений полуреакций: полуреакция восстановления Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O 1 полуреакция окисления H2S - 2 e- = S(т) + 2H+ 3 г) составляют, суммируя уравнения полуреакций, ионное уравнение данной реакции, т.е. дополняют запись (б): Cr2O72- + 8 H+ + 3 H2S = 2 Cr3+ + 7 H2O + 3 S(т) д) на основе ионного уравнения составляют молекулярное уравнение данной реакции, т.е. дополняют запись (а), причем формулы катионов и анионов, отсутствующие в ионном уравнении, группируют в формулы дополнительных продуктов (K2SO4): K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4 е) проводят проверку подобранных коэффициентов по числу атомов элементов в левой и правой частях уравнения (обычно достаточно только проверить число атомов кислорода). Пример 7. Подберите коэффициенты методом электронно-ионного баланса в уравнении окислительно-восстановительной реакции: KMnO4 + H2SO4 + Na2SO3 → MnSO4 + H2O + Na2SO4 + K2SO4 Решение MnO4-+ 8 H+ + 5 e- = Mn2+ + 4 H2O 2 SO32- + H2O -2 e- = SO42- + 2 H+ 5 2 MnO4-+ 6 H+ + 5 SO32- = 2 Mn2+ + 3 H2O + 5 SO42- 2 KMnO4 + 3 H2SO4 + 5 Na2SO3 = 2 MnSO4 + 3 H2O + 5 Na2SO4 + K2SO4 Пример8. Подберите коэффициенты методом электронно-ионного баланса в уравнении окислительно-восстановительной реакции: Na2SO3 + KOH + KMnO4 → Na2SO4 + H2O + K2MnO4 Решение MnO4- + 1 e- = MnO42- 2 SO32- + 2 OH- -2 e- = SO42- + H2О 1 SO32- + 2 OH- + 2 MnO4- = SO42- + H2O + 2 MnO42- Na2SO3 + 2 KOH + 2 KMnO4 = Na2SO4 + H2O + 2 K2MnO4 Пример 9.Подберите коэффициенты методом электронно-ионного баланса в уравнении окислительно-восстановительной реакции: Сu + HNO3 → Cu(NO3) 2 + NO2 + H2O Решение NO3- + 2H+ + e = NO2 + H2O 2 Cu + 2e = Cu2+ 1 ---------------------------------------------------------- 2NO3- + 4H+ + Cu = 2NO2 + 2H2O + Cu2+ Сu + 4HNO3 = Cu(NO3) 2 + 2NO2 + 2H2O Пример 10.Определите, протекает ли самопроизвольно в прямом направлении реакция: KI + Cl2 = I2(т) + KCl Решение Cравним значения потенциалов полуреакций окисления и восстановления I2 +2e =2I- φ0восс. = 0,54 В Cl2 +2e =2Cl- φ0окис. = 1,34 В Так как ε0 = 1,34 – 0,54 = 0,8 В ε0 > 0 или φ0окис. > φ0восс. , значит возможно самопроизвольное протекание реакции в прямом направлении. Пример 11.Определить, может ли самопроизвольно протекать в стандартных условиях реакция окисления-восстановления иодид-ионов ионами Fe3+. 2Fe3+ + 2I- = Fe2+ + I2 Решение. а) Находим разность между стандартным электродным потенциалом пары окислителя Е0Fe3+/Fe2+ и восстановителя Е0(I2/I-): ∆Е0= Е0(Fe3+/Fe2+) - Е0(I2/I-) = 0,771 - 0,536 = 0,235B. Данная реакция может самопроизвольно протекать в прямом направлении, потому что разность потенциалов окислителя и восстановителя величина положительная (больше нуля). б) Определим константу равновесия данной реакции в стандартных условиях по формуле: lgK = Данная реакция может протекать в прямом направлении и константа равновесия составляет восемь порядков.
Поиск по сайту: |
 анод(-)
анод(-)
 lg
lg  ;
; lg
lg  = Е0 +
= Е0 + 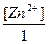 = Е0 +
= Е0 +  , тогда К = 107,966
, тогда К = 107,966