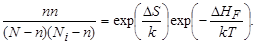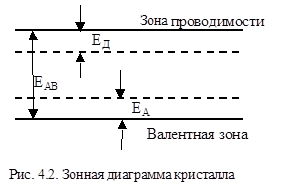|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Отображение реакций дефектов на зоннойСтр 1 из 2Следующая ⇒
Дефекты нестехиометрии Неизбежность нарушения законов стехиометрии В кристаллических веществах Представления о возникновении тепловых дефектов в бинарном кристалле, изложенные выше, основаны на том, что появление дефектов в кристалле есть результат тепловых флуктуаций в решетке, когда отдельные частицы приобретают энергию, достаточную для их ухода из регулярных узлов. На языке термодинамики это означает, что процесс образования дефектов рассматривается как гомогенная внутрикристаллическая реакция, не связанная с наличием других фаз. В действительности же другие фазы присутствуют. При описании состояния реального кристалла его нельзя рассматривать как закрытую однофазную термодинамическую систему, не учитывая присутствия других фаз и вызванного этим неизбежного обмена веществом между рассматриваемым кристаллом и этими фазами, то есть окружающей средой. Если при рассмотрении процесса дефектообразования и определения равновесной концентрации дефектов использовать закрытую термодинамическую систему (а равновесная термодинамика имеет дело только с закрытыми системами), то такая система должна включать в себя как минимум, еще хотя бы одну фазу. Наиболее простым является случай, когда кристалл находится в равновесии с собственным паром. В этом случае система состоит из двух фаз: твердое тело и газ. Равновесие кристалл - пар может быть описано следующими реакциями:
АВкр « АВгаз ; Кр = РАВ , (4.1)
АВгаз « Агаз + Вгаз ; Кдис = (РАРВ)/РАВ , (4.2)
Агаз + АВкр « А1+ХаВ ; (раствор А в АВ) , (4.3)
Вгаз + АВкр « АВ1+Хв ; (раствор В в АВ) . (4.4)
Равновесие процессов (4.3) и (4.4) определяется законами распределения и можно записать XA = LA PA , XB = LB PB, где XA и XB – концентрации растворенных в кристалле АВ компонентов А и В; LA и LB – коэффициенты пропорциональности, представляющие собой коэффициенты распределения А и В между газовой и твердой фазами. В общем случае они не равны друг другу LA ¹ LB. Так что, если PA = PB, то XA ¹ XB. Поэтому состав твердой фазы окажется не таким, какого требуют законы стехиометрии. Общее количество компонента А не будет равно количеству компонента В. В рассмотренной схеме процесса мы считали, что из твердой фазы в газовую вещество переходит в виде молекул, которые затем диссоциируют, а образовавшиеся атомы распределяются между газовой и твердой фазами. Для выводов, которые делает термодинамика, путь процесса не имеет значения. Рассмотрим другой путь. Пусть процесс начинается с распада вещества в твердой фазе.
АВтв « Атв + Втв ; КАВ = ХАХВ ,
Атв « Агаз ; КА = РА/ХА ,
Втв « Вгаз ; КВ = РВ/ХВ .
Откуда получаем, что ХА = РА/КА, ХВ = РВ/КВ. Видно, что константы 1/КА и 1/КВ имеют тот же смысл, что и LA и LB. В общем случае КА ¹ КВ, поэтому даже если РА = РВ ХА¹ ХВ. Таким образом, нарушение стехиометрии оказывается неизбежным. Следовательно, нестехиометрия представляет собой объективно существующее свойство химического соединения, проявляющееся в виде самопроизвольного нарушения численных соотношений между компонентами химического соединения по сравнению с теми соотношениями, которые реализуются законами стехиометрии.
Квазихимический метод исследования Реакций дефектов
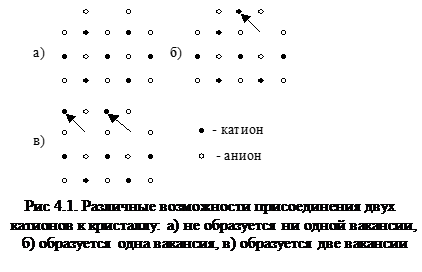
Сущность метода: к реакциям дефектов, их написанию и истолкованию применяют тот же подход, что и к обычным химическим реакциям. С этой целью структурные элементы решетки, в том числе вакансии и междоузлия, рассматривают как химические индивиды, способные взаимодействовать друг с другом. На этом основании вакансии в узлах и незанятые междоузлия иногда называют квазичастицами. При написании реакций будем пользоваться символикой Крегера и Винка, в которой приняты следующие обозначения: АА – катион в узле решетки, ВВ – анион в узле решетки, VA – вакансия в катионной подрешетке, VB – вакансия в анионной подрешетке, VI – незанятое междоузлие, AI – катион в междоузлии, BI – анион в междоузлии, VS – незанятый поверхностный узел, MA – посторонний (примесный) атом в катионном узле. Написание квазихимических реакций требует соблюдения определенных принципов (правил). Принцип 1. Принцип постоянства отношения количества разносортных узлов кристаллической решетки. Пусть в результате частиц А из газовой фазы в твердую они занимают регулярные узлы в катионной подрешетке. Сколько при этом возникает вакансий? Возможные варианты представлены на рис. 4.1. При рассмотрении квазихимических процессов принимает ся, что число вакансий, возникших в анионной подрешетке, строго эквивалентно числу частиц, перешедших из газовой фазы и занявших узлы в катионной подрешетке. Принцип формулируется следующим образом: отношение числа кристаллографических узлов разного сорта в решетке данного соединения всегда постоянно, независимо от действительного состава вещества.
Принцип формулируется следующим образом: отношение числа кристаллографических узлов разного сорта в решетке данного соединения всегда постоянно, независимо от действительного состава вещества. Для бинарного кристалла AB это соотношение можно выразить как NA/NB = const, где NA и NB – число узлов A и B в катионной и анионной подрешетках, соответственно. Таким образом, если все узлы заняты реальными атомами, кристалл окажется стехиометрическим. Нестехиометрическими являются кристаллы, у которых отношение числа разнородных атомов не равно отношению числа кристаллографических узлов разного сорта. Принцип 2. Принцип действующих масс. Подобно тому, как равновесие химической реакции A + B « C + D может быть описано с помощью закона действующих масс,
ABкр + Aгаз « VB + (A1+X B)кр , (4.5)
где XVB – равновесная концентрация вакансий, образовавшихся в анионной подрешетке; PA – давление компонента A; aAB и aA1+xB – активности твердой фазы AB начального состава и обогащенной компонентом A. Когда нарушения стехиометрии невелики, эти величины мало отличаются друг от друга. Поэтому равенство (4.6) можно переписать в виде K = XVB/PA. То есть, при определении константы равновесия учитываются лишь концентрации тех частиц и квазичастиц, которые выступают как дефекты, и не принимаются во внимание все остальные компоненты, несмотря на то, что они участвуют в реакции. Реакцию (4.5) можно переписать как Aгаз « VB. Однако такая запись не учитывает принципа эквивалентности узлов разного сорта. Чтобы это учесть в выражение вводят член, символизирующий занятые узлы, причем число последних должно быть эквивалентно числу возникших вакансий: Aгаз « AA + VB. При написании выражения для константы равновесия этот член не учитывается. Принцип 3. Принцип электронейтральности кристалла с дефектами. В обычных условиях любой кристалл, находящийся в равновесии с окружающей средой, электронейтрален. Предположим, что мы имеем ионный кристалл, окруженный парами компонента А, и что при переходе из паровой фазы в твердую частица А диссоциирует с образованием положительно заряженного иона и электрона A0 « A+ + e . Возникшие ионы A+ занимают регулярные узлы в решетке. Таким образом, мы должны записать:
Aгаз « AA + VB +e.
Из такой записи можно сделать вывод, будто в кристалле возникает избыток отрицательных зарядов, хотя в действительности кристалл остается электронейтральным. Это заблуждение возникает вследствие того, что регулярные частицы, несущие на себе реальные заряды, не учитываются при написании выражения принципа действующих масс. Чтобы избавиться от такого заблуждения Крегер ввел понятие "эффективный заряд дефекта". Не принимаемым в расчет регулярным частицам, независимо от их реального заряда, так же, как и междоузлиям, приписывается нулевой эффективный заряд, а под эффективным зарядом дефекта подразумевается заряд по отношению к заряду того структурного элемента бездефектного кристалла, на месте которого этот дефект локализован. Например, любой ион, локализованный в междоузлии, будет иметь положительный или отрицательный эффективный заряд, так как в совершенном кристалле реальный заряд междоузлия равен нулю. Замена двухзарядного иона Ba в BaO на двухзарядный ион стронция не изменит эффективный заряд последнего, он останется равным нулю. Однако, если вместо Ba2+ в тот же узел поместить Al3+, его эффективный заряд окажется равным +1. Введены специальные обозначения: · – положительный эффективный заряд, ' – отрицательный эффективный заряд, ´ – нулевой эффективный заряд. Трудность, возникшую при написании последнего уравнения, можно преодолеть, если для компенсации заряда, который несет электрон, вакансии приписать противоположный по знаку эффективный заряд:
Aгаз « AA + VB· + e.
Является обязательным соблюдение принципа: сумма всех положительных эффективных зарядов должна быть равна сумме отрицательных. Это и есть принцип электронейтральности кристалла с дефектами. Убедимся в том, что метод квазихимической аналогии пригоден для написания процессов дефектообразования. Рассмотрим тепловой беспорядок по Френкелю. Запишем реакцию образования дефектов:
AA +Vi « Ai + VA.
Если кристалл содержит N атомов и Ni междоузлий, то при достижении равновесия, когда n частиц покинут свои узлы и перейдут в междоузлия, число частиц, оставшихся в узлах, окажется равным N – n, а число незанятых междоузлий Ni – n. Тогда константа равновесия запишется в виде
Это выражение для константы равновесия, в сущности, не отличается от того, которое было получено методом статистической термодинамики и так как
то
Учитывая, что N >> n , Ni >> n и приравнивая Ni = aN, DS/k = lnA, получим n = Na1/2A1/2exp(–DHF/2kT). Это выражение идентично выражению, полученному методом статистической термодинамики. При квазихимическом описании теплового разупорядочения по Шоттки следует рассматривать равновесие реакции между частицами в регулярных узлах и незанятыми узлами на поверхности кристалла:
AA + VS « AS + VA,
Так как nAs = nVs, nVA = n и N >> n, то KS = n/N. Заменяя KS его значением по уравнению изотермы реакции и введя обозначения X = KS и А = exp(DS/k), получим X = Aexp(–DHS/kT). Это выражение идентично уравнению, полученному методом статистической термодинамики. Как видим, квазихимический метод дает те же результаты, что и метод статистической термодинамики.
Отображение реакций дефектов на зонной Диаграмме кристалла
Рассмотрим следующий процесс Агаз « AA + VB·+ e. Под воздействием сил, удерживающих частицы кристалла, атомы компонента А, переходящие из газовой фазы в твердую, меняют степень окисления, отдавая свои валентные электроны кристаллу. Для веществ с сильно выраженной ионной связью такой процесс чаще всего заканчивается локализацией электронов на образовавшихся при этом анионных вакансиях, поскольку они окружены положительным зарядом. Однако связь таких электронов с решеткой будет гораздо менее прочной по сравнению с теми электронами, которые локализованы на анионах. По этой причине их часто называют квазисвободными электронами. Рассмотрим зонную модель ионного кристалла (рис. 4.2). Об энергии связи электронов, локализованных на анионах, можно судить по ширине запрещенной зоны, так как перевод электрона из валентной зоны в зону проводимости означает, что эта связь утрачена. Для этой цели нужна энергия ЕАВ. Энергетический уровень, характеризующий квазисвободные электроны, располагается в запрещенной зоне вблизи дна
зоны проводимости. Для перевода таких электронов в зону проводимости требуется небольшая энергия ЕД. Этот уровень называется донорным, поскольку он является поставщиком электронов в зону проводимости. Переход электрона с дефекта в зону проводимости может быть осуществлен, например, за счет теплового воздействия на кристалл. В таких случаях процесс VB « VB·+ e называется термической ионизацией дефекта. Пусть тот же кристалл находится в парах компонента В. Тогда происходит следующая реакция: Вгаз « ВВ + VA¢+ h. Если частицы В достраивают анионную подрешетку, они должны приобрести отрицательный заряд. Поставщиком электронов для этой цели является валентная зона. Покидая ее, электроны оставляют после себя положительные дырки. Чтобы обеспечить условие электронейтральности, приходится образовавшимся катионным вакансиям приписать отрицательный эффективный заряд. Энергетический уровень, на который переводится электрон из валентной зоны, называемый акцепторным уровнем, также расположен в запрещенной зоне, но ближе к потолку валентной зоны. Свободные электроны и дырки в кристалле могут образоваться также при переходе электронов из валентной зоны в зону проводимости. Квазихимическая реакция, описывающая этот процесс, будет следующей: 0 « e + h. Ноль в левой части равенства символизирует, что при сдвиге равновесия влево кристалл становится бездефектным.
Поиск по сайту: |
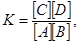 где K – константа равновесия реакции, так по аналогии для характеристики равновесия реакций дефектов может быть использован принцип действующих масс. При этом вакансии и другие дефекты рассматриваются как полноправные химические индивиды. Можно, например, записать
где K – константа равновесия реакции, так по аналогии для характеристики равновесия реакций дефектов может быть использован принцип действующих масс. При этом вакансии и другие дефекты рассматриваются как полноправные химические индивиды. Можно, например, записать (4.6)
(4.6) .
.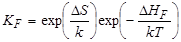 ,
,