 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Теоретическое обоснование
Проблема устойчивости - проблема "жизни и смерти" дисперсной системы - одна из важнейших в коллоидной химии. Лиофильные системы диспергируются самопроизвольно, так как свободная энергия в таком процессе уменьшается и образуются термодинамически устойчивые коллоиды:
Лиофобные системы самопроизвольно не диспергируются, величина F>0, такие коллоиды термодинамически неустойчивы, однако кинетически 35 они вполне устойчивы, не изменяются заметно в течение длительного времени. Потеря устойчивости дисперсной системой приводит к ее коагуляции - слипанию частиц с последующим разделением фаз. Опытные наблюдения и теория коагуляции гидрофобных коллоидов (ДЛФО) позволяют говорить о двух факторах устойчивости: а) электростатическом барьере, обусловленном силами отталкивания заряженных коллоидных частиц; б) адсорбционно-сольватном барьере, окружающем частицу и препятствующем ее сближению с другими частицами.
Первый фактор определяется величиной заряда и -потенциала частицы, которые, в свою очередь, зависят от типа и концентрации ионов в растворе. Любой электролит вызывает коагуляцию коллоидного раствора при увеличении его концентрации до критического значения Ск - порога коагуляции. Обратную величину называют коагулирующей способностью электролита. Коагулирующее действие оказывает противоион, и его способность возрастает пропорционально некоторой высокой степени его заряда - правило Шульце-Гарди. Согласно теории ДЛФО увеличение заряда противоиома от 1 до 3 повышает величину V в отношении 1 : 64 : 729.
Таким образом, электролиты в коллоидном растворе понижают величину заряда и -потенциала частицы и устраняют электростатический барьер. Второй фактор устойчивости коллоидов - адсорбционно-сольватный барьер - зависит от степени лиофилизации дисперсной фазы.
Ориентация молекул в сольватных слоях приводит к свойствам, характерным для твердых тел: высокой вязкости, упругости - и препятствующим взаимопроникновению слоев при сближении частиц. Многие золи имеют развитые и прочные гидратные оболочки. Еще большего развития достигают сольватные слои при адсорбции длинноцепочечных поверхностно-активных веществ (ПАВ) и макромолекул ВМС. Эти вещества называют стабилизаторами, а создаваемый ими барьер - структурно-механическим.
Оба вида устойчивости взаимосвязаны и могут быть интерпретированы на одной основе. Дерягин ввел понятие расклинивающего давления, суть которого заключается в следующем: при сближении частиц на малое расстояние их ионные атмосферы и сольватные слои перекрываются, концентрация ионов и молекул ПАВ в узком зазоре между частицами увеличивается по сравнению с объемом раствора. Следствие – появляется осмотическое давление растворителя, стремящееся выравнять концентрации в этом узком промежутке.
Если система потеряла устойчивость и в ней произошла коагуляция, то иногда можно провести обратный процесс - пептизацию и перевести коагулят в золь. Способ проведения пептизации зависит от причин, вызвавших коагуляцию. В случае концентрационной коагуляции, наступившей при С >Ск, следует отмыть коагулят от электролита водой, используя декантацию или диализ. В случае же адсорбционной коагуляции необходимо повысить заряд и потенциал путем добавления электролита, содержащего потенциалопределяющие ионы. Результаты работы Ый золь
Расчёт порога коагуляции для KCl
Расчёт порога коагуляции для CaCl2
Расчёт порога коагуляции для AlCl3
Проверка закона Шульце-Гарди
0,08:0,275:0,00385 = 1:64:729
12,5 : 3,63 : 259,74 = 1 : 64 : 729
Ой золь
Расчёт порога коагуляции для KCl
Расчёт порога коагуляции для CaCl2
Расчёт порога коагуляции для AlCl3
Проверка закона Шульце-Гарди
16,7 : 6,06 : 606,06 = 1 : 64 : 729
Вывод: мы определили порог коагуляции и коагулирующей способности электролитов, изучили влияние величины заряда противоиона на устойчивость коллоидов и убедились в правильности закона Шульце-Гарди.
Поиск по сайту: |
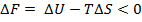









 :
:  :
:  :
:  :
:  = 1 : 64 : 729
= 1 : 64 : 729 :
:  :
:  = 1 : 64 : 729
= 1 : 64 : 729





 :
:  :
:  = 1:64:729
= 1:64:729