 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Цель и задачи Дисциплины «теория горения и взрыва».
Целью дисциплины «Теория горения и взрыва» является изучение физико-химических основ горения в свете современных представлений теории горения и взрыва, а также оценка взрывобезопасности на различных объектах железнодорожного транспорта.
Задачи дисциплины: - Изучение основных понятий, терминов и определений в рассматриваемой области знаний. - Анализ физико-химических свойств горючих газов. - Теория горения газов, реакции горения и их тепловой эффект, изучение цепного механизма реакций горения. - пределы воспламенения и температуры горения. - Расчет давления, развиваемого при взрыве газов. - Классификация методов сжигания. - Основы теории диффузионного горения. - Горение и токсичные продукты сгорания, механизмы их образования. - Взрывы, пожары и оценка взрывобезопасности.
Основные физико-химические свойства горючих газов. Ацетилен – согласно ГОСТ 5191-79 обозначается буквой А Ацетилен – один из основных горючих газов, применяемых при газовой резке и сварке металлов, химическая формула С2Н2. Технический ацетилен (с примесями) обладает специфичным резким неприятным запа-хом, вызванный содержащимися в нем примесями сернистого водорода, фосфористого водо-рода, аммиака и т.д. Длительное вдыхание его вызывает тошноту, головокружение и даже отравление. Ацетилен обладает наркотическим действием. Газообразный ацетилен легче воздуха и накапливается в высших точках слабо проветри-ваемых помещений, где возможно образование ацетилено-воздушной смеси. С воздухом и кислородом ацетилен образует взрывоопасные смеси. Ацетилен обладает способностью самовоспламеняться в чистом виде (термический рас-пад ацетилена) и в смеси с воздухом, температура самовоспламенения – 335 оС. При длительном соприкосновении ацетилена с медью и серебром образуются взрывоопасные соединения. Пропан-бутановая смесь – согласно ГОСТ 5191-79 обозначается буквой П Пропан-бутан – смеси искусственных газов пропана С3Н8 – до 30% и бутана С4Н10 – до 70%, присутствуют, кроме того, в небольших количествах некоторые другие газы. Легко сжижаем, хранится в баллонах в сжиженном состоянии. Пропан-бутановые смеси значительно тяжелее воздуха, поэтому при утечке они скапли-ваются внизу над полом помещения и во всевозможных углублениях, что может привести к образованию взрывоопасных концентраций. Природный газ (метан) – в соответствии с ИСО 5175-87 обозначается буквой М Природный газ представляет собой смесь различных углеводородов с преимуществен-ным содержанием метана СН4 (до 90 – 98 % по объему), не имеет цвета, обладает легким за-пахом чеснока и токсичными удушающими свойствами, в два раза легче воздуха, поэтому при утечках скапливается в верхней части помещения. Транспортировка природных газов к месту потребления производится по трубопроводам под небольшим избыточным давлением или, реже, в баллонах под давлением до 15 МПа. Основные газовые законы. Закон Бойля-Мариотта Изотермический процесс (T = const, m = const): p1, p2 и p3– давления газа в состоянии 1, 2 и 3 (Па); V1, V2 и V3– объемы газа в состоянии 1, 2 и 3 (м3). При увеличении объема газа его давление во столько же раз уменьшается и наоборот. Этим можно воспользоваться для проверки результата. Закон Шарля Процессы можно считать изобарными, если они проходят: P/Т=const где V1 и V2 – объемы газа в состоянии 1 и 2 (м3 ); T1 и T2 – температуры газа в состоянии 1 и 2 (К). Закон Гей-Люссака газовый закон: для данной массы данного газа при постоянном давлении отношение объема к абсолютной температуре есть величина постоянная
Закон Дальтона один из основных газовых законов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов. Закон Паскаля основной закон гидростатики: давление, производимое внешними силами на поверхность жидкости или газа, передается одинаково по всем направлениям.
Поиск по сайту: |

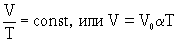 ,где =1/273К -1 - температурный коэффициент объемного расширения.
,где =1/273К -1 - температурный коэффициент объемного расширения.