 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Теория электролитической диссоциации (Аррениус, Каблуков ). Роль осмоса в биосистемах. Плазмолиз, гемолиз, тургор. Гипо-, изо-, гипертонические растворы.
1.теория электролитической диссоциации.( стр. 80) Вант-Гофф считал, что коэффициент i для каждго вещества- постоянная величина, не зависящая от концентрации. Однако шведский ученый С.Аррениус показал экспериментально, что величина I зависит от концентрации раствора. С разбавлением раствора изотонический коэффициент растет.Арениус пришел к выводу, что диссоциация молекул электролитов на ионы идет уже в процессе растворения. Ионизация (электролитическая диссоциация )- распад молекул на ионы. Процесс диссоциации обратим (справедливо для слабых электролитов). Наряду с распадом электролитов на ионы идет обратный процесс рекомбинации - образование из ионов молекул. В растворе устанавливается ионное равновесие. Диссоциация в растворе увеличивает число частиц. Именно поэтому изотонический коэффициент принимает величину больше единицы. Теория Аррениуса не учитывала химического взаимодействия растворенного вещества с растворителем. Поэтому количественно эта теория не могла объяснить различную степень диссоциации одного и того же электролита в разных растворителях. Каблуков и Кистяковкий отмечали ,что электролитическая диссоциация вызывается не только ослаблением притяжения ионов в растворителе, но и сольватацией- взаимодействием полярных молекул растворителя с частицами растворенного вещества . именно сольватация является главной причиной диссоциации частиц растворенного вещества. *** Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы. Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа:
Константа диссоциации
Значение
где 2.Роль осмоса в биологических системах. Плазмолиз, гемолиз, тургор.(стр. 74) Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблюдается осмос. Растворы, имеющие одинаковое осмотическое давление, называются изотоническими. Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением является гипертоническим по отношению ко второму, а второй – гипотоническим по отношению к первому. При помещении клеток в изотонический раствор они сохраняют свой размер и нормально функционируют. При помещении клеток в гипотонический раствор вода из менее концентрированного внешнего раствора переходит внутрь клеток, что приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Такое разрушение клеток называется лизисом, в случае эритроцитов этот процесс называется гемолизом. Кровь с клеточным содержимым, выходящим наружу при гемолизе, за свой цвет называется лаковой кровью.При помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор, и наблюдается сморщивание (высушивание) клеток. Это явление называется плазмолизом. Биологические жидкости человека (кровь, лимфа, тканевые жидкости) представляют собой водные растворы низкомолекулярных соединений – NaCI, KCl, СаС1, высокомолекулярных соединений – белков, поли–сахаридов, нуклеиновых кислот и форменных элементов – эритроцитов, лейкоцитов, тромбоцитов. Их суммарным действием определяется осмотическое давление биологических жидкостей. Осмотическое давление крови человека при 310°К (37°С) составляет 780 кПа (7,7 атм). Такое же давление создает и 0,9%-ный водный раствор NaCI (0,15 моль/л), который, следовательно, изотоничен с кровью (физиологический раствор). Однако в крови кроме ионов Na и С1 имеются и другие ионы, а также ВМС и форменные элементы. Поэтому в медицинских целях более правильно использовать растворы, содержащие те же компоненты и в том же количестве, что и входящие в состав крови. Эти растворы применяют в качестве кровезаменителей в хирургии. Человеческий организм, помимо осмотического давления, характеризуется постоянством (гомеостазом) и других физико-химических показателей крови например кислотности. Допустимые колебания осмотического давления крови весьма незначительны и даже при тяжелой патологии не превышают нескольких десятков кПа. При различных процедурах в кровь человека и животных в больших количествах можно вводить только изотонические растворы.При больших потерях крови (например, после тяжелых операций, травм) больным вводят по несколько литров изотонического раствора для возмещения потери жидкости с кровью. Явление осмоса широко используют в медицинской практике. Так, в хирургии применяют гипертонические повязки (марлю, смоченную в гипертоническом 10%-ном растворе NaCl), которые вводят в гнойные раны.По закону осмоса ток жидкости раны через марлю направляется наружу, в результате чего рана постоянно очищается от гноя, микроорганизмов и продуктов распада. Плазмолиз- отделение протопласта от клеточной стенки в гипертоническом растворе. Гемолиз-разрушение эритроцитов с выходом гемоглобина в окружающую эритроциты среду. Тургор- внутреннее гидростатическое давление в живой клетке, вызывающее напряжение клеточной оболочки. Гипотонический раствор- раствор, имеющий более низкое осмотическое давление, чем клеточный сок. Всасывание воды клеткой возможно только из гипотонических растворов. При погружении клетки в гипотонический раствор, происходит осмотическое проникновение воды внутрь клетки с развитием её гипергидратации — набухания с последующим цитолизом. Растительные клетки в данной ситуации повреждаются не всегда; при погружении в гипотонический раствор, клетка будет повышать тургорное давление, возобновляя своё нормальное функционирование. Гипертонический раствор- раствор, имеющий бо́льшую концентрацию вещества по отношению к внутриклеточной. При погружении клетки в гипертонический раствор, происходит её дегидратация — внутриклеточная вода выходит наружу, что приводит к высыханию и сморщиванию клетки. Гипертонические растворы применяются при осмотерапии[1] для лечения внутримозгового кровоизлияния. Изотонический раствор- равенство осмотического давления в жидких средах и тканях организма, которое обеспечивается поддержанием осмотически эквивалентных концентраций содержащихся в них веществ. Изотония — одна из важнейших физиологических констант организма, обеспечиваемых механизмами саморегуляции. Изотонический раствор — раствор, имеющий осмотическое давление, равное внутриклеточному. Клетка, погружённая в изотонический раствор, находится в равновесном состоянии — молекулы воды диффундируют через клеточную мембрану в равном количестве внутрь и наружу, не накапливаясь и не теряясь клеткой. Отклонение осмотического давления от нормального физиологического уровня влечёт за собой нарушение обменных процессов между кровью, тканевой жидкостью и клетками организма. Сильное отклонение может нарушить структуру и целостность клеточных мембран.
Поиск по сайту: |

 определяется активностями катионов
определяется активностями катионов  , анионов
, анионов  и недиссоциированных молекул
и недиссоциированных молекул  следующим образом:
следующим образом:
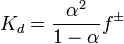 ,
, — средний коэффициент активности электролита.
— средний коэффициент активности электролита.