 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Скорость реакции горения
Скорость химической реакции горения определяется числом молекул, реагирующих веществ в рассматривающем объеме за единицу времени. W - скорость химической реакции Ni - число молекул i -го исходного вещества в момент времени t. Nj - число молекул j -го конечного вещества в момент времени t. V - объем г.с. (стехиом. сост. изолир. системы) Условие сохранения элементарного состава: где miK - число атомов К-го элемента в i -ой молекул Вк - общее число атомов в горючей системе
W - скорость химической реакции ni, nj - стехиометрический коэффициент Если объем системы не меняется в ходе реакции, то скорость определяется производной объемной концентрации во времени
сi ,сj - объемные концентрации веществ Если реакция происходит в результате соударения молекул двух веществ А1 и А2, то такая реакция - бимолекулярная:
где с - концентрация исходного вещ-ва А1, А2 к - константа скорости реакции. Константа скорости реакции зависит от температуры и учитывает то, что не каждое столкновение реакционно-способных молекул веществ А1 и А2 привод. к образованию новых молекул, т.е. хим реакций. Экспериментальное определение скорости химической реакции состоит в измерении концентрации какого-либо реагирующего вещества и в дифференцир. в зависимости концентр. от времени.
19.Химическое равновесие в реакциях горения В действительности даже в стехеометрической смеси превращение исходных веществ в конечное никогда не может пройти до полного преобразования исходных веществ. По достижении определенных определенных условий становится значимым обратный процесс превращения конечных веществ в исходное, возникает динамическое равновесие прямого и обратного химического превращения. Любая хим реакция явл-ся обратимой. Наряду с прямой реакцией Идет обратная реакция Если в каком-либо процессе скорости прямой и обратной реакции сравниваются, то дальнейшего изменения состава смеси не происходит и система приходит к состоянию динам рав-сия. Для равновесных концентраций исходных вещ-в и продуктов реакции хар-но след-ее соот-ие:
20.Диссоциация продуктов горения Если взять за основу понятие динам.равновесия, то состав продуктов равновесного горения в отличии от от стехиометр.полного горения опр-ся процессами диссоциации. СО2 - СО+0,5О2 k = Р co *Рo20,5/ Рco2 Р- парц.давление в горюч.системе Химическое превращение конечных веществ в исходные часто называют диссоциацией продуктов горения. Область применения продуктов горения 1. Отсутствие диссоциации 2. Слабая диссоциация 3. Сильная диссоциация Область применения продуктов горения.
21. Определение констант равновесия Если в каком-либо процессе скорости прямой и обратной реакции сравниваются, то дальнейшего изменения состава смеси не происходит и система приходит к состоянию динам рав-сия. Для равновесных концентраций исходных вещ-в и продуктов реакции хар-но след-ее соот-ие:
К- константа равновесия. Данное уравнение представляет собой один из вариантов записи закона действующих масс. Константы равновесия для многих реакций определены и приводятся в термодинамических таблицах, описывающих свойства отдельных веществ. Пример: Ур-ние реакции диссоц. Ф-ла const равновесия СО2 = СО+0,5О 2 k1= Pco * Po20,5/ Pco2 H2 O = H2 +0,5O2 k2= PH2 * PO20,5 / PH2O H2 = 2H k3= PH2 / PH2
22. Состав продуктов равновесного горения Чтобы рассчитать состав продуктов равновесного горения,нужно решить систему Ур-ний, включ.в себя: - Ур-ние констант равновес.реакций диссоц. - Ур-ние баланса хим. Элементов - Ур-ние общего кол-ва продуктов горения.
Расчет сводится к следующему: 1. проводится расчет стехеометрически полного горения 1 м3 горючего газа при α=1, при этом вычисляются значения О1, L1, H2Oα=1, CO2α=1 2. удельное количество углекислого газа при α<1 определяется из выражения
Цепная реакция Сложная реакция, в кот.происходит послед.повторение определ.превращений, описываемых простыми реакциями с участием актив.частиц, наз-ся цепной реакцией. Для большинства реакций горения скорость рассчит-ая по числу молекул горючего и окислителя не совпадает с экспер-ми значениями. Кинетика реакций основ-ая на столкновении молекул наз-ся макрокинетикой горения, кинетика, учитывающая участие в хим превращениях атомов, радикалов и др активных частиц наз-ся микрокинетикой горения. В соот-ии с микрокинетикой горения, исходные вещ-ва превращаются в ходе реакции в конечные вещ-ва не сразу, а посредствам образования активных частиц, которые сравнительно легко вступают в дальнейшие соединения. В результате этих соединений получаются конечные продукты и одновременно образуется некоторое кол-во активных вещ-в. Акт-ые частицы могут вновь вступать в соединения, заново повторяя цикл превращений. Повторение цикла будет происходить до тех пор, пока не прекратится воссоздание активных вещ-в. Сложная реакция, в которой происходит послед-ое повторение опред-ых превращений, описываемых простыми реакциями с участием активных частиц (звеньями) наз-ся реакцией цепочечного типа или цепной реакцией. После начального возбуждения такая реакция повт-ся несколько раз, не нуждаясь в подводе энергии из вне. Бывают неразветв-ые и раветв-ые цепные реакции.
Поиск по сайту: |
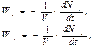
 ,
,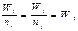 где
где
 ,
, , протекающей со скоростью
, протекающей со скоростью 
 , протекающей со скоростью:
, протекающей со скоростью: 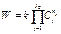 .
.
 , К- константа равновесия. Данное уравнение представляет собой один из вариантов записи закона действующих масс.
, К- константа равновесия. Данное уравнение представляет собой один из вариантов записи закона действующих масс.



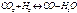





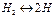


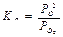



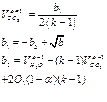
 ,
,  -вспомогательные величины; k-константа равновесия реакции водяного газа
-вспомогательные величины; k-константа равновесия реакции водяного газа
 -температура горения в Кельвинах, может быть приблизительно определена при помощи следующего выражения
-температура горения в Кельвинах, может быть приблизительно определена при помощи следующего выражения
 -энтальпия продуктов горения при 200
-энтальпия продуктов горения при 200  ;
; 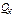 -тепловая энтальпия горючих веществ в продуктах сгорания
-тепловая энтальпия горючих веществ в продуктах сгорания

