 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
VII. Направленность самопроизвольного протекания химических процессов. ⇐ ПредыдущаяСтр 2 из 2
Согласно принципу Бертло-Томсена самопроизвольно протекают только экзотермические реакции. В изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к росту энтропии (∆S>0).
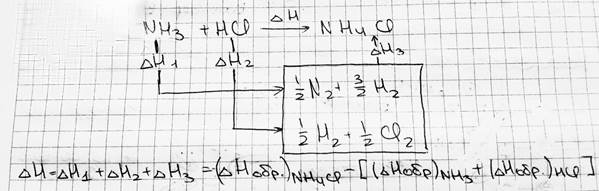
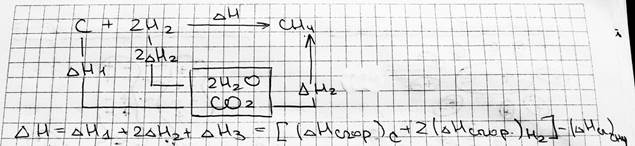
#2. Термохимия: тепловой эффект реакций, закон Гесса и следствия из него, термохимические рас-чёты. Термохимия — это раздел химии, который изучает тепловые эффекты тепловых реакций в пересчёте на 1 моль вещества. Закон Лапласа-Лавуазье: Если при образовании какого-либо соединения выделяется некое количество теплоты Q, то и для разложения этого соединения при тех же условиях потребуется такое же количество теплоты Q. Энтальпия образования — то количество теплоты Q, которое выделяется при образовании 1 моль вещества из простых веществ. Используется наиболее устойчивое (пример: из O2 и O3 выбираем О2). Теплота сгорания — то количество теплоты, которое выделяется при сгорании 1 моль вещества, измеренное тогда, когда продукты реакции охлаждены до комнатной температуры. Закон Гесса: Теплота реакции зависит только от начального и конечного состояний вещества. Не зависит от промежуточной стадии процесса — функция состояния (при условии, что работа положительна, т.е. работа по расширению; p, T=const). Выводы из закона Гесса: 1) Энтальпия образования не зависит от способа получения вещества; 2) Теплота разложения вещества до одинаковых продуктов равна и противоположна по знаку его теплоте образования этих продуктов; 3) Тепловой эффект реакции равен алгебраической сумме теплот образования реагентов из простых веществ, т.е. ΔH=Σ (ΔHобр)продуктов - Σ (ΔHобр)исходных
4) Тепловой эффект реакции равен сумме теплот сгорания реагентов до одинаковых продуктов, т.е.
#3. Химическая кинетика. Основные понятия химической кинетики. Гомогенные и гетероген-ные химические реакции. Зависимость скорости гомогенных и гетерогенных реакций от кон-центрации реагирующих веществ, температуры, давления. Влияние других факторов. Энергия активации, активированный комплекс. Гомоген-ный и гетерогенный катализ. Химическая кинетика — это раздел химии, который изучает скорости химических превращений. Либо гетерогенных систем — две и более фаз, либо гомогенных систем — одна фаза. Фаза — это часть системы, которая отделена от других частей системы поверхностью системы, причём при переходе из одной фазы в другую свойства меняются скачком. Пример: смеси газов. Гомогенные реакции идут по всему объёму системы. Гетерогенные реакцииидут на поверхности раздела фаз. Интермедиальные реакции — реакции с участием промежуточных веществ. Прекурсор — промежуточное или исходное вещество; конечный продукт реакции — токсин, наркотик или взрывчатое вещество. Пример: соляная кислота, ацетон. vгомогенной реакции =Δn/Δt*ΔV=ΔCM/Δt=± dCM/dt ΔV – единица объёма vгетерогенной реакции =Δn/Δt*S S – единица площади Принципы химической кинетики: 1. принцип детального равновесия: скорость прямой и обратной реакции в состоянии химического равновесия равны; 2. В случае стационарного процесса в любом бесконечно малом объёме этот стационарный процесс характеризуется независимостью всех термодинамических параметров. Влияние параметров на скорость реакции: aA+bB → cAB Концентрация. vгом=K*[A]a [B]b=K CAaCBb,где CA и CB — молярные соблюдается при a+b⩽3
tg(α) = a → касательная в точке S a+b – общий порядок реакции vгом ~ С vгет=K*(const ~ S)* CBb = {K*(const ~ S) ≡ K } = K*CBb Давление 2H2(г)+O2(г) → 2H2O(г) v = K* P2H2*PO2 (*) p↑ в 2 раза => v↑ в 4 раза (из (*))
Температура. Вант-Гофф: при увеличении температуры на 100 скорость химической реакции увеличивается в 3-4 раза. v2=v1* γ (T2-T1)/10 Уравнение Аррениуса: k=A*exp(Ea/RT) K = f(t; свойств вещества) k ≠ f(C)
Катализ — процесс изменения скорости химической реакции за счёт веществ, называемых катализаторами, которые участвуют в химической реакции, но не входят в конечные продукты (катализаторы и ингибиторы). Гомогенный катализатор — та же фаза, что и у реагирующих веществ. Гетерогенный катализатор— иная фаза, чем у реагирующих веществ. Пример: 2SO2+O2 → 2 SO3 (гомогенный) A+B → [A..B] → AB A+B+K → [A..K]+B → [A..K..B] → AB + K Образуются комплексы с меньшей энергией активации – активированные комплексы. Состояние активированного комплекса характеризуется тем, что в нем уже нет исходных веществ, но нет еще и продуктов реакции. Активированный комплекс подобен нормальной молекуле, он отличается лишь тем, что одно из его колебаний легко возбуждается, что может привести к распаду комплекса и образованию продуктов. Пример: 2SO2+O2 → {V2O5} → 2SO3 (гетерогенный)
aA+bB → pC+qD v=K CAaCBb Цепные реакции — реакции, скорость которых со временем возрастает. Характеризуются высоким энергетическим выходом. Могут ускоряться или замедляться примесями.
Br*+Br*=Br2 Реакцию характеризует коэффициент разложения. В таких цепных реакциях не действуют два принципа химической кинетики.
aA+bB = pC+qD vпр=K CAa CBb vобр=K` CCp CDq vпр = vобр => K/K`= CCpCDq/CAaCBb = Kравновесия (1) Концентрации в формуле (1) называются равновесными. Состояние химического равновесия — это состояние, когда vпр=vобр, тогда и (1) является постоянной, называемой константа равновесия. Kр → ∞: реакция идёт быстро и бурно, исходных веществ мало, а продуктов много. Химическое равновесие сдвинуто вправо. ΔG<0; |ΔG|→∞: Kр → 0: продуктов мало, исходных много. Химическое равновесие сдвинуто влево. ΔG>0. Кр → 1: реакция идёт вяло и быстро затухает. ΔG≈0. Если на атом, который находится в состоянии химического равновесия, оказать воздействие путём увеличения концентрации участника химической реакции, то в первый момент времени получает преимущество та реакция, в ходе которой это вещество расходуется. С течением времени система придёт в состояние равновесия, причём концентрация изменится, а константа равновесия нет. 1. газ: P↑ => точка равновесия сдвинута в сторону реакции, в ходе которой получается меньшее число газовых молекул. твёрдое вещество и жидкость: Давление не сказывается на химическом равновесии. Пример: Fe2O3 (тв.)+3H2(г.)=2Fe(тв.)+3H2O(г.) ΔH>0 T↑, P↑; какая реакция получит преимущество? Kp=PH2O3/PH23 => газа одинаково, давление не влияет 2. Повышение температуры смещает точку равновесия в сторону эндотермической реакции (поглощение теплоты). Необходимо учитывать тепловой эффект. Принцип Ле Шателье: Если на систему оказывать воздействие извне, то она старается это воздействие скомпенсировать.
Поиск по сайту: |
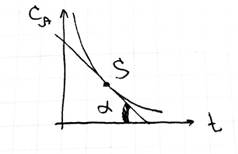 a и b на самом деле берут из кинетических кривых
a и b на самом деле берут из кинетических кривых
 Закон действующих масс:
Закон действующих масс: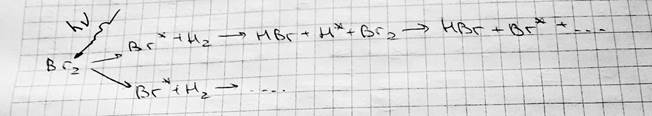
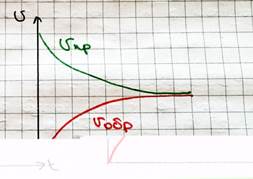 #4. Химическое равновесие, описание. Влияние внешних факторов на состояние химического равновесия, принцип Ле Шателье.
#4. Химическое равновесие, описание. Влияние внешних факторов на состояние химического равновесия, принцип Ле Шателье.