 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Тест-комплект «Сульфаты».
Состав тест-комплекта: мерная склянка с пробкой; пипетки-капельницы, мерная пипетка с медицинским шприцем и соединительной трубкой; универсальная индикаторная бумага,; контрольная цветовая шкала; раствор гидроксида натрия (0,1 моль/л); раствор соляной кислоты (0,1 моль/л); раствор ортанилового К в этаноле; раствор хлорида бария (0,02 моль/л экв.). Проведение анализа: 1. Налить в склянку 2,5 мл анализируемого раствора, предварительно им же ополоснув 2-3 раза. С помощью универсальной индикаторной бумаги довести рН среды до рН 4 (прибавляя пипеткой раствор гидроксида натрия или соляной кислоты). 2. Добавить раствор ортанилового К до метки «5 мл», закрыть склянку пробкой и встряхнуть. 3. Постепенно добавлять раствор хлорида бария до появления неисчезающей зеленовато-голубой окраски. Определить объем хлорида бария, израсходованный на титрование ( 4. Рассчитать массовую концентрацию сульфат-иона (
где 48 – эквивалентная масса сульфат-иона; 1000 – коэффициент пересчета г/л в мг/л;
Тест-комплект «Карбонаты, щелочность».Продолжительность выполнения анализа не более 10 мин. Состав тест-комплекта: мерная склянка с пробкой; пипетки-капельницы, мерная пипетка с медицинским шприцем и соединительной трубкой; раствор индикатора фенолфталеина; раствор индикатора метилового оранжевого; раствор соляной кислоты (0,05 моль/л). Проведение анализа: 1. Налить в склянку 10 мл анализируемого раствора, предварительно им же ополоснув 2-3 раза. 2. Добавить 3-4 капли раствора фенолфталеина, закрыть склянку пробкой и встряхнуть. 3. Постепенно добавлять раствор соляной кислоты до обесцвечивания раствора, перемешивая его покачиванием склянки. Определить объем соляной кислоты, израсходованный на титрование ( 4. Добавить в эту же склянку 1 каплю раствора метилового оранжевого, закрыть склянку пробкой и встряхнуть. Во вторую склянку (контрольную) налить 10 мл анализируемого раствора, добавить 1 каплю раствора метилового оранжевого, закрыть склянку пробкой и встряхнуть. 5. В первую склянку постепенно добавлять раствор соляной кислоты до перехода желтой окраски в оранжевую (переход контролировать, сравнивая с контрольной пробой), перемешивая раствор покачиванием склянки. Определить объем соляной кислоты, израсходованный на титрование с метиловым оранжевым ( 6. Вычисляя по таблице, определить потребление соляной кислоты гидроксид-, карбонат- и гидрокарбонат-ионами:
7. Рассчитать массовую концентрацию карбонат-иона (
где 60 – молярная масса карбонат-иона; 61 – молярная масса гидрокарбонат-иона; 1000 – коэффициент пересчета г/л в мг/л;
Поиск по сайту: |
 , мл).
, мл). , мг/л) по формуле:
, мг/л) по формуле: ,
,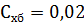 моль/л экв. – эквивалентная концентрация раствора хлорида бария;
моль/л экв. – эквивалентная концентрация раствора хлорида бария; мл – объем пробы, взятый на анализ.
мл – объем пробы, взятый на анализ. , мл). При бесцветной окраске раствора до титрования принять
, мл). При бесцветной окраске раствора до титрования принять  .
. , мл) и общий (
, мл) и общий ( 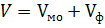 , мл). При оранжевой окраске раствора до титрования принять
, мл). При оранжевой окраске раствора до титрования принять  .
.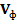 и
и 
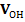 , мл
, мл
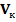 , мл
, мл
 , мл
, мл
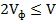
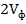


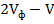

 , мг/л) и гидрокарбонат-иона (
, мг/л) и гидрокарбонат-иона (  , мг/л) по формулам:
, мг/л) по формулам: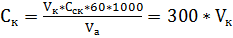 ,
, ,
, моль/л – молярная концентрация раствора соляной кислоты;
моль/л – молярная концентрация раствора соляной кислоты;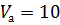 мл – объем пробы, взятый на анализ.
мл – объем пробы, взятый на анализ.