 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Общее представление о трансляции. Материальное обеспечение процесса.Стр 1 из 3Следующая ⇒
Министерство здравоохранения и социального развития Российской Федерации Казанский государственный медицинский университет Кафедра медицинской биологии и генетики
Трансляция. Экспрессия гена. Основные закономерности в регуляции экспрессии генов. Казань, 2005
Рассматриваемые вопросы
1. Общее представление о трансляции. Материальное обеспечение процесса. 2. Периоды трансляции. а. Инициация. б. Элонгация в. Терминация. г. Нарушение трансляции 3. Посттрансляционные процессы. Фолдинг и модификация белка. 4. Экспрессия генов. Особенности экспрессии генов у про- и эукариот. а. Этапы экспрессии генов у эукариот. б. Особенности экспрессии генов у прокариот. 5. Регуляция экспрессии гена. 5.1. Регуляция экспрессии генов у прокариот, на уровне инициации транскрипции. 5.1. Регуляция экспрессии генов у эукариот.
Общее представление о трансляции. Материальное обеспечение процесса. Трансляция – это процесс переноса информации (декодирование её) в рибосомах с иРНК в аминокислотную последовательность белка. Это сложный процесс, имеющий собственное сырьевое, ферментативное и энергетическое обеспечение. В трансляции задействованы следующие органические соединения и органоиды.
1. иРНК 2. тРНК. 3. рРНК. 4. Различные ферменты. 5. Рибосомы 6. АТФ Рассмотрим каждое из них. а) иРНК В предыдущем разделе мы описали, как «созревает» иРНК во время и после транскрипции. У эукариот этот процесс идёт практически всё время пока иРНК находится в ядре, где она связана с белком и представляет собой рибонуклеопротеид называемый информосомой. Переходя в цитоплазму, иРНК выходит из комплекса с ядерным белком и через ядерные поры попадает в цитоплазму, где вновь связывается с белком, формируя цитоплазматическую информосому. В виде информосомы иРНК может существовать в цитоплазме достаточно долго. Фактически это выработанная в эволюции форма депонирования иРНК в клетке. При необходимости, например во время митоза, когда сильная компактизация хромосом практически выключает синтез всех видов РНК, информосомы распадаются и освободившаяся иРНК включается в трансляцию. б) тРНК
Рис. 63. Пространственная структура тРНК.
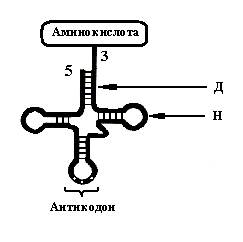
к месту синтеза белка. Существует около 20 тРНК. Их пространственная структура, независимо от типа, универсальна (см. рис. 63). Отметим три особенности в структуре тРНК. 1. Наличие в тРНК минорных оснований.Эти основания существенно отличаются по физико-химическим параметрам от классических оснований имеющихся в иРНК и рРНК. Это придаёт молекуле тРНК целый ряд свойств, которые не характерны для других РНК. Например, молекулы тРНК достаточно стойкие и не подвергаются разрушительному действию внутриклеточных нуклеаз. 2. В нити тРНК выявлены участки, где имеются обратные повторы нуклеотидов. Это приводит к тому, что при сближении между собой обратные повторы создают двунитчатые структуры за счёт образования комплементарных пар между основаниями обратных повторов. На рисунке один такой участок обозначен буквой «Д». Другие участки тРНК из-за отсутствия комплементарных повторов остаются не спаренными. На этом же рисунке один такой участок обозначен буквой «Н». Наличие в нити тРНК участков с уникальной последовательностью нуклеотидов и обратными повторами создаёт своеобразную вторичную структуру тРНК называемую «кленовым листом». 3. В структуре тРНК имеются две области значимые для трансляции – область антикодонаи область присоединения аминокислоты. Антикодон – группа из трёх нуклеотидов, располагающаяся на одном из конце РНК. Антикодон занимает фиксированное положение и комплементарен кодону, находящемуся в информационной РНК. Другая область – 3’ конец. К нему специальный фермент присоединяет аминокислоту. Комплекс тРНК с аминокислотой носит название аминоацил-тРНК. Таким образом, в синтезе белка принимают участие не свободные аминокислоты, а аминокислоты в составе аминоацил-тРНК.
Фермент, который присоединяет аминокислоту к тРНК, имеет два распознающих центра (рис. 64). Один центр определяет необходимую тРНК путём
Фермент А Б В Рис.64. Схема формирования аминоацил-тРНК. А – компоненты –тРНК, аминокислота, фермент. Б – фермент присоединяет аминокислоту к тРНК в соответствии с петлёй тРНК. В – после присоединения фермент удаляется, а тРНК остаётся с присоединённой аминокислотой. взаимодействия с некоторыми специфическими областям на её молекуле ( петлями и в некоторых случаях с антикодоном. Другой центр распознаёт среди массы окружающих его в цитоплазме аминокислот ту, которая соответствует триплету в антикодоне. После того как фермент определил необходимую тРНК и аминокислоту происходит присоединение аминокислоту к 3’ концу тРНК.
в) рРНК. рРНК синтезируются на структурных генах и после процессинга накапливаются в ядрышке ядра. В ядрышке в зависимости от молекулярного веса различают несколько типов рРНК. Все они участвуют в строительстве рибосом, являясь своеобразным каркасом к которому прикрепляются множество различных по структуре и функции белков. Объединяет белки то, что они являются участниками различных этапов трансляции. Белки в ядрышко поступают через ядерные поры из цитоплазмы.. Таким образом, в ядрышках формируются «полуфабрикаты» малой и большой субъединицы рибосом. В таком виде они выходят через ядерные поры в цитоплазму, где формирование малой и большой субъединицы полностью заканчивается. В полностью сформированной малой субъединице расположена одна рРНК, в большой – их несколько. рРНК находясь в рибосомах выполняет несколько функций, главные из которых следующие: - рРНК является каркасом для формирования белковой основы рибосом, - рРНК принимает участие в формировании инициаторного комплекса, - рРНК обеспечивает взаимодействие тРНК с мРНК. В цитоплазме малая и большая субъединица находятся в диспергированном состоянии (отдельно друг от друга).
г) Рибосома.
Рис. 64. Два функциональных центра в рибосомах до соединения субъединиц и после.
Процесс трансляции, как и любой процесс матричного синтезе, состоит из трёх стадий – инициации, элонгации и терминации.
Периоды трансляции. а. Инициация. Рибосомы находятся в цитоплазме в трёх состояниях: - диспергированном, когда большая и малая субъединицы находятся отдельно друг от друга,
Диспергированные Отдельная Полирибосома рибосомы рибосома (полисома)
Рис. 65. Состояния рибосом в цитоплазме.
- в состоянии комплекса, когда малая и большая субъединица объединены в один ансамбль, а между ними проходит иРНК. - в форме полиробосомы (полисомы) – на одну нить иРНК «нанизаны» несколько рибосомальных комплексов. Каждый из них синтезирует белок (см. рис. 65). В инициации происходит процесс формирования инициаторного комплекса. В это процесс входят три следующих друг за другом этапа. 1. Малая субъединица рибосомы определяет 5’ конец иРНК, содержащий «кэп», и присоединяется к нему. 2. Скользя по иРНК, малая субъединица «находит» расположенный вблизи «кэпа» стартовый кодон. В этом месте субъединица останавливается и фиксируется на иРНК. Сформировалась система, состоящая из двух элементов - малой субъединицы и нити иРНК. Система устроена таким образом, что в малой субъединицы располагаются только 2 кодона, каждый из них занимает свою активную область или центр или П или А. Стартовый кодон располагается в функциональном центре «П» (рис. 66, А). В другом функциональном центре (А) располагается кодон первой аминокислоты входящей в белок. Еще раз подчеркнём, что два функциональных центра в малой субъединице не активны. Они активируются только при присоединении большой субъединице, в которой находятся аналогичные центры П и А.
 
А + =
Малая субъединица иРНК
Метиониновая Инициаторный аминоацил-тРНК комплекс
В + = 3’
Большая субъединица Рис. 66. Схема формирования инициаторного комплекса и рибосомы. А – малая субъединица рибосомы соединяется с иРНК. Б – антикодон метиониновой-тРНК соединяется с кодоном иРНК в участке «П». Формируется инициаторный комплекс. В – инициаторный комплекс соединяется с большой субъединицей рибосомы. Формируется рибосома.
У многих организмов стартовый кодон (или инициирующий кодон) в иРНК содержит триплет комплементарный антикодону аминоацил-тРНК несущий метионин. С метионинового кодона, как правило, начинается синтез белка. 3. К стартовому кодону, находящемуся в «П» участке, прикрепляется аминоацил-тРНК, несущая аминокислоту метионин. Комплекс, состоящий из малой субъединице рибосомы, иРНК, метиониновой-тРНК называют инициаторный комплекс (рис.66, Б).
Б. Элонгация Как только к инициаторному комплексу присоединяется большая субъединица рибосомы, начинается этап инициации. С присоединением большой субъединицы в рибосоме формируются два полноценных функциональных центра «П» и «А». В обоих центрах размещаются только два кодона иРНК. В центре «П» находится метиониновая-тРНК, а к участку «А», который открыт в цитоплазму, пробуют присоединиться аминоацил-тРНК несущие разные аминокислоты. Присоединяется только та аминоацил-тРНК, антикодон которой комплементарен кодону иРНК, находящемуся в«А» участке. В нашем случае в «А» участок попадает триптофановая аминоацил-тРНК (Т) (рис.67, В, Г).

3’ 3’
3’ 3’
Ж З
Рис. 67. Схема трансляции. А – компоненты аппарата трансляции (малая, большая субъединицы рибосом, иРНК, аминоацил-тРНК, тРНК и аминокислоты) в цитоплазме перед началом синтезе белка. Б – инициаторный комплекс. В – начало элонгации. Большая и малая субъединица соединены, в функциональном центре «П» аминоацил-тРНК с метионином (М). Г – в функциональном центре «А» аминоацил-тРНК с триптофаном (Т). Д – соединение аминокислот метионина и триптофана в функциональном центре «А». Ж – перемещение аминокислот вместе с ДНК в центр «П». З – центр «А» заполнен аминоацил-тРНК, которая несёт аминокислоту глицин (Г).
Специальные ферменты соединяют пептидной связью две аминокислоты находящиеся в функциональных участках между собой (рис. 67, Д). Одновременно происходит разрыв между тРНК и аминокислотой метионином. Метионин остаётся присоединённым к триптофану в участке «А», а в участке «П» находится освобождённая от аминокислоты тРНК (рис. 67, Е). Специальный фермент, используя энергию макроэргов (АТФ) продвигает рибосому по иРНК на один триплет (шаг) по направлению к 3’ концу иРНК . При этом из участка «П» тРНК освобождается и выходит в цитоплазму, а её место занимает аминоацил-тРНК несущая триптофан (Т) и прикреплённый к триптофану метионин (М). «А» центр становится свободным и на кодон, находящейся в нём иРНК, начинают претендовать другие цитоплазматические аминоацил-тРНК (рис. 67, Ж). Присоединяется та аминокислота, антикодон которой комплементарен кодону иРНК «А» участка (рис. 67, З). Затем цикл повторяется. Функциональные обязанности малой и большой субъединиц рибосом, различны. Малая субъединица присоединяет аминоацил-тРНК (т.е. декодирует информацию), а большая субъединица отвечает за образование пептидной связи между аминокислотами. В. Терминация. Конец трансляции наступает тогда, когда в «А» участок рибосомы попадает один из стоп-кодонов (УАГ, УАА, УГА). Для них нет соответствующих аминоацил- тРНК и процесс синтеза белка останавливается. К стоп-кодону присоединяются факторы терминации (белки), которые активируют ферменты, находящиеся в рибосомах. Эти ферменты, в свою очередь, осуществляют процесс отщепления синтезированного белка от тРНК и вызывают диссоциацию рибосомы на субъединицы. Следует отметить интересный феномен, наблюдаемый в терминации. Ранее мы отмечали (см раздел «Процессинг»), что конец нити иРНК, где располагается терминатор, заканчивается полиадениловым «хвостиком» - Поли-А . При окончании синтеза полипептида, рибосома сходит с нити иРНК, «откусывая» при этом одно адениловое основание от Поли-А. Следующая рибосома, завершив синтез, также отщепляет одно основание и т.д. Как только все основания будут утрачены, иРНК разрушается ферментами. Таким образом, Поли-а, являются своеобразными биологическими часами, отмеряющими длительность существования иРНК и количество синтезированных с определённой иРНК белков. Длиннее Поли-А – больше молекул белка будет синтезироваться с этой иРНК и наоборот. г. Нарушение трансляции. Трансляция, как и другие процессы матричного синтеза, может быть нарушена различными факторами внутренней и внешней среды. Достаточно часто такие нарушения связаны с воздействием на процесс химических агентов, самой различной природы. В медицинской практике нарушение трансляции процесса может происходить при употреблении антибиотиков. В этом случае в основе механизма повреждения ДНК чаще всего лежат три феномена. 1. Антибиотик может связаться с активным центром рибосомы (например, с «П» или «А» центром) и блокировать взаимодействие с этим центром участников процесса трансляции. Так стрептомицин связывается с «П», а тетрациклин с «А» центром рибосом у микроорганизмов, полностью подавляя их активность. Следует отметить, что в рибосоме человека другая структура этих центров, поэтому с ними эти антибиотики не связываются. Однако другой антибиотик – пуромицин, связывается с «А» центром рибосом человека и прекращает трансляцию. Понятно. что в качестве лекарственного препарата его можно использовать с очень большой осторожностью. 2. Другой механизм действия веществ нарушающих синтез белка заключается в присоединении их к какому либо ферменту-участнику синтеза. В этом случае фермент выключается из процесса. Так дифтерийный токсин инактивирует некоторые ферменты на этапе элонгации. 3. Дистантный механизм действия химических соединений заключается в воздействии химического агента не на сам процесс трансляции, а на структуры которые определяют его течение. Такие структуры располагаются в различных областях клетки. Ими могут быть рецепторы, располагающие на поверхности плазматической мембраны. Химический агент, связываясь с рецептором индуцирует в цитоплазме цепочку биохимических реакций, которые влияют на интенсивность трансляции, вплоть до её полного прекращения. Примерно так действует интерферон.
МЗ. Это перевод информации из полинуклеотидной последовательности иРНК в аминокислотную последовательность белка. Осуществляется этот перевод путём синтеза белка на матрице – иРНК. В трансляции принимают участие рибосомы, тРНК, рРНК, различные ферменты. Состоит из трёх этапов – инициации, элонгации и терминации. На стадии инициации образуется инициаторный комплекс, который состоит из малой субъединице рибосомы, иРНК, тРНК несущей метионин. После присоединения к нему большой субъединице рибосомы наступает стадия элонгации, который заключается в присоединении тРНК, несущих аминокислоты к иРНК и связывание аминокислот друг с другом. Процесс происходит в двух активных центрах, расположенных на границе малой и большой субъединице. Трансляция заканчивается, когда в рибосому попадает «бессмысленный» кодон, не кодирующий аминокислоты.
Поиск по сайту: |
 тРНК в ядре, также как и иРНК, соединена с белком и представляет собой рибонуклеопротеид. Попадая в цитоплазму, она также соединяется с белками. Основная функция тРНК – доставка аминокислот
тРНК в ядре, также как и иРНК, соединена с белком и представляет собой рибонуклеопротеид. Попадая в цитоплазму, она также соединяется с белками. Основная функция тРНК – доставка аминокислот
 Аминокислота
Аминокислота  Петля
Петля

 тРНК
тРНК

 Состоит из малой и большой субъединицы. Важно отметить, что в большой и малой субъединице имеются два функциональных центра: - «П» (пептидильный) и «А» (аминоацильный), которые объединяются после соединения субъединиц.Белки, находящиеся в составе рибосомы, выполняют структурную и ферментативную роль.
Состоит из малой и большой субъединицы. Важно отметить, что в большой и малой субъединице имеются два функциональных центра: - «П» (пептидильный) и «А» (аминоацильный), которые объединяются после соединения субъединиц.Белки, находящиеся в составе рибосомы, выполняют структурную и ферментативную роль.





 Кэп Стартовый кодон
Кэп Стартовый кодон





 Б + =
Б + =








 Инициаторный комплекс
Инициаторный комплекс








 3’
3’


 Б
Б А
А 





 Г В
Г В

 Д Е
Д Е 3’ 3’
3’ 3’