|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Некоторые функции аминокислот в организме
ПЕПТИДЫ, ИХ ФИЗИОЛОГИЧЕСКАЯ РОЛЬ В ОРГАНИЗМЕ
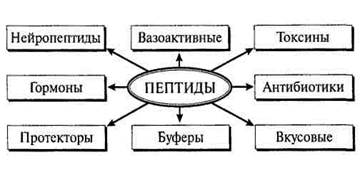
Пептиды – это полимеры аминокислот (до 10), имеющие меньшую молекулярную массу, чем белки. В природе известны два типа пептидов: первые синтезируются и выполняют определенную физиологическую роль в организме; вторые образуются за счет химического или ферментативного гидролиза в организме или вне его. Ферментативное образование пептидов происходит в желудочнокишечном тракте человека в процессе переваривания белков пищи. Для многих природных пептидов установлены структура и роль их в организме. Важнейшие группы пептидов приведены на рисунке.
Рассмотрим функции некоторых из них. Нейропептиды. Выделены из мозга животных. Многие из них формируют поведение человека и животных. Их содержание крайне мало. Для выделения первых нейропептидов (1969–70 г.г.) были использованы тонны мозговой ткани тысяч животных. Но они регулируют важнейшие функции высшей нервной системы, например, пищевое насыщение, сон, обучаемость, удовольствие, двигательную активность и др. Обнаружены пептиды, снижающие болевые ощущения (морфиноподобные, или опиодные). Установлено, что разные нейропептиды могут образовываться из одного предшественника путем последовательного отщепления фрагментов. Например, из исходного пептида (200 аминокислот) образуются последовательно пептиды с различными функциями – 91 АК; 31 АК и последний – 5 АК: Тир-Гли-Гли-Фен-Мет, который относится к группе опиодных пептидов, способных подавлять болевое ощущение и вызывать состояние эйфории, удовольствия. Эти же пептиды отрицательно действуют на память и обучаемость. Известно, что среди продуктов неполного гидролиза белков молока и хлеба обнаружены пептиды опиоидного действия. Они могут всасываться в кровь при нарушении пищеварения в тонком кишечнике и оказывать воздействие на психику человека. Поскольку многие нейропептиды имеют достаточно простое строение, они сравнительно легко могут быть получены методами органического синтеза. С открытием нейропептидов открылась возможность направленного воздействия на элементы психики человека. Например, осуществлять коррекцию сна. В настоящее время в мире проводятся исследования по выделению и изучению нейропептидов с целью получения искусственным путем БАВ для включения их в состав лекарственных препаратов. Пептидные токсины. Некоторые мощные токсины микробного происхождения имеют белково-пептидную природу. Например, токсин, выделяемый Clostridium botulinum, вызывает тяжелые пищевые отравления (ботулизм). Чаще всего причиной этого являются консервы домашнего приготовления. Известно 5 энтеротоксинов, вырабатываемых Staphilococcus aureus. Токсины змей, пчел, скорпионов также имеют пептидную природу. Гриб бледная поганка отличается высоким содержанием пептидных токсинов очень активного действия. Содержание токсина в грибе составляет 0,4 мг на 1 г массы. Смертельная доза для человека – 5–7 мг, т.е. практически достаточно одного гриба. Пептидные токсины продуцируются также морскими моллюсками и скорпионами. Вкусовые пептиды. Наиболее известны сладкие и горькие пептиды. Из этой группы широко известен подсластитель аспартам, состоящий из остатков двух аминокислот – аспарагиновой кислоты и фенилаланина. Он почти в 200 раз слаще сахара, не токсичен, однако при длительном хранении и тепловой обработке сладость его уменьшается. В молочных продуктах при гидролизе белков образуются пептиды с горьким вкусом, например, при созревании сыра. Это снижает качество готового продукта. Горькие пептиды представляют собой низкомолекулярные гидрофобные соединения, содержащие от 2 до 8 остатков аминокислот. По мере гидролиза пептидов горький вкус, как правило, исчезает. Протекторные пептиды. Наиболее интересен глутатион (Глу-Цис-Гли). Он обладает полифункциональными свойствами. Содержится в каждой живой клетке. По своей природе это трипептид. В наибольших количествах обнаружен в дрожжах и зародышах пшеницы. Глутатион регулирует окислительно-восстановительные реакции, защищает свободные –SH-группы (сульфгидрильные) белков от окисления. Он принимает на себя действие окислителя и тем самым защищает белок. При окислении глутатиона образуется межмолекулярная дисульфидная связь (в процессе участвуют две молекулы глутатиона). Есть ферменты (тиоловые), у которых в активном центре содержится сульгидрильная группа. Если эта группа окислена с образованием дисульфидной (–S-S–) связи, фермент не проявляет активности. Глутатион активирует тиоловые ферменты (восстанавливает их). При этом восстанавливается и каталитическая функция фермента. Глутатион также защищает от окисления витамин С (аскорбиновую кислоту) и другие соединения, выполняет функции радиопротектора, детоксикатора (обезвреживает соединения ртути, токсичные перекисные соединения, фосфоорганические соединения). Нарушения обмена глутатиона в организме человека вызывает заболевание костного мозга, развитие катаракты и ряд других нарушений функций организма. В пищевой технологии источником значительного количества глутатиона являются дрожжи. Т. е. его действие может проявляться во всех процессах, где используется брожение. В первую очередь это относится к хлебопекарному производству. Пептиды-буферы. Обнаружены, например, в мышцах различных животных и человека – карнозин и ансерин. Буферные свойства их связаны с наличием имидазольного кольца гистидина. Отличительная особенность – присутствие в них остатка β-аланина. Карнозин и ансерин являются, например, составной частью экстрактивных веществ мяса. Их содержание достигает 0,2–0,3 %. Пептиды-гормоны. Вырабатываются клетками желез внутренней секреции и поступают в кровь для регуляции деятельности отдельных органов и организма в целом. Например, гормон окситоцин регулирует секрецию молока молочной железой. Вазопрессин, сходный по строению с окситоцином, кроме регулирования секреции молока, способен также регулировать водный баланс, осмотическое давление крови, а также стимулировать процессы запоминания. Гормоны окситоцин и вазопрессин выделяются задней долей гипофиза. Гормоны гипоталамуса – тиролиберин, люлиберин и соматостатин принимают участие в процессе высвобождения гормонов передней доли гипофиза. Так, тиролиберин контролирует высвобождение тиротропина – гормона, участвующего в работе щитовидной железы; люлиберин регулирует выделение лютропина – гормона, влияющего на деятельность половых органов; соматостатин регулирует активность гормона роста соматотропина. Известен также пептидный гормон меланотропин, который выжеляется в кровь промежуточной долей гипофиза и ответственен за образование пигмента, обусловливающего цвет глаз, кожи, волос (меланин). Вазоактивные пептиды Относятся к группе пептидов, оказывающих влияние на тонус сосудов. Например, ангиотензин проявляет сосудосуживающее действие. Он состоит из 8 аминокислотных остатков, образуется из белка сыворотки ангиотензиногена при последовательном действии протеолитических ферментов. Пептиды-антибиотики. Представители: грамицидин S – циклический антибиотик, синтезируется бактериями Bacillus brevis; суфрактин, синтезируется бактериями Bacillus subtilis. Эффективны в борьбе с инфекционными заболеваниями, вызываемыми различными видами микроорганизмов, например, стрептококками и пневмококками. Грамицидин способен переносить ионы К+ и Na+ через мембраны клеток. Антибиотик, выделяемый плесневыми грибами Penicillium, по структуре – дипептид, построенный из остатков D-валина и цистина. Антибиотики группы пенициллина эффективны в борьбе с инфекциями, вызываемыми стафилококками, стрептококками и др. микроорганизмами. В условиях повышенных нагрузок, стрессов, неблагоприятных антропогенных воздействий, характерных для современной жизни, значение функционального питания в здоровье человека чрезвычайно велико. Диетические и лечебные свойства ферментированных молочных продуктов известны с древнейших времен. Как известно, при производстве любых кисломолочных напитков происходит сквашивание молока, при котором среди прочих, протекают процессы частичного протеолиза с разной степенью деградации белковых частиц и образованием пептидных фрагментов, имеющих достаточно большой разброс по молекулярным массам. Часть осколков белковых молекул занимает промежуточное место между крупными белковыми конгломератами и свободными аминокислотами по длине аминокислотной цепи, которая и наделяет некоторые олигопептиды функциональными свойствами, исполняющие роль регуляторов в живых организмах. Помимо количества аминокислот, входящих в регуляторный пептид на биологическую активность олигопептида влияют качественный состав, устойчивость к протеолитическим ферментам и т.д. Кроме того, основной белок молока, в частности его бета-фракция при попадании в желудочно-кишечный тракт начинает расщепляться на фрагменты под воздействием протеаз. Один из фрагментов, состоящий из семи аминокислот, переваривается так медленно, что может постепенно проникать сквозь стенки кишечника, попадать в кровь, а затем и в мозг. В экспериментах на животных удалось выяснить, что этот пептид (его назвали бета-казоморфин-7) действует подобно истинным гормонам. Он влияет на многие системы, несмотря на то, что приходит извне, а не вырабатывается организмом. Пептид улучшает обучение, кроме того, олигопептиды молока обладают выраженным иммуномодулирующим действием, значительно улучшают секрецию желудочного сока, способны принимать участие в регуляции организма без участия коры головного мозга. До середины ХХ в. считалось, что пептиды не являются самостоятельным классом органических соединений, а представляют собой продукты неполного гидролиза белков, которые образуются в ходе переваривания пищи, в технологическом процессе или при хранении пищевых продуктов. И только после того как В. дю Виньо (1953) определил последовательность остатков аминокислот двух гормонов задней доли гипофиза — окситоцина и вазопрессина - и воспроизвел их синтез химическим путем, появилась новая точка зрения на физиологическую роль и значение данной группы соединений. Сегодня обнаружено большое количество пептидов, которые обладают индивидуальной последовательностью аминокислот и даже не встречаются в гидролизатах природных белков. Это говорит о сложности механизма образования пептидов: либо путем деградации крупного агрегата нативного белка, либо путем присоединения остатков аминокислот с образованием пептидной связи и в том и другом случае физиологической активностью обладают гетерополиаминокислоты со сравнительно короткой аминокислотной цепью. Регуляторные пептиды, обладающие широким спектром биологической активности, могут быть эффективным средством коррекции нарушений гомеостаза. Интерес к регуляторным пептидам и бурное развитие исследований в этой области возникли в 1970-х годах после работ, выполненных в Нидерландах группой исследователей под руководством Д. де Вида. Группой исследователей было установлено, что адренокортикотропный гормон (АКТГ) передней доли гипофиза, включающий 39 аминокислотных остатков (АКТГ1 – 39), ранее широко известный как стимулятор выброса гормонов коры надпочечников, способен оказывать выраженное действие на обучаемость животных. Вначале возникло предположение о том, что это действие связано с гормональным эффектом АКТГ, но впоследствии удалось показать, что небольшие фрагменты АКТГ — АКТГ4 -10 и даже АКТГ4 – 7, лишенные гормональной активности, оказывают стимулирующий эффект на обучаемость, не уступающий по силе эффекту целой молекулы. В дальнейшем способность стимулировать процессы памяти были показаны для гипоталамического нейрогормона вазопрессина, дотоле известные функции, которого ограничивались влиянием на сосудистый тонус и на водный обмен. В результате этих и последовавших за ними обширных экспериментов было установлено, что регуляторные пептиды составляют обширную регуляторную систему, обеспечивающую широкий спектр межклеточных регуляторных процессов в организме, причем не только в центральной нервной системе, как думали в начале (отсюда и название «нейропептиды»), но и в периферических системах. Поэтому в настоящее время термин «регуляторные пептиды» является более употребительным. По современным представлениям система регуляторных пептидов принимает участие в регуляции практически всех физиологических реакций организма и представлена огромным количеством регуляторных соединений: уже сейчас их известно более тысячи и это число, по-видимому, не окончательное. В организме человека и животных регуляторные пептиды выполняют функции медиаторов, что позволяет по-новому взглянуть на принципы гуморальной регуляции. Если раньше понимание этой регуляции основывалось на представлении о существовании небольшого количества эндокринных желез, «дирижировавших» внутренней средой организма, то имеющиеся сведения о системе регуляторных пептидов позволяют рассматривать в качестве такой железы практически каждый орган и характеризовать межклеточные и межорганные взаимодействия как постоянно ведущийся «диалог». Многие из регуляторных пептидов обнаружены в значительных количествах, как в ЦНС, так и в периферических органах. Так, вазоактивный интестинальный пептид (ВИП), холецистокинин и нейропептид У обнаружены в головном мозгу и в органах желудочно-кишечного тракта. Желудок выделяет пептидный гормон гастрин, почки — ренин и т. д. Замечено, что регуляторный пептид, освобождающийся в кровь или спинномозговую жидкость из одного участка организма, побуждает другие органы стимулировать или, напротив задерживать выброс других регуляторных пептидов, что, в свою очередь запускает новую волну регуляторных процессов. Мощная фармакологическая активность олигопептидов научно доказана. Кроме того, некоторые из них нашли достаточно широкое применение как лекарственные препараты благодаря ярко выраженным антиоксидантным (пептиды группы карнозина), ноотропным (стимулирующим умственную деятельность, процессы обучения и т.д.), иммуномодулирующим, адаптогенным (в том числе при воздействии критических факторов, например, физической нагрузки), репродуктивным, нейроэндокринным свойствам. Причем, в данном случае не рассматриваются высокомолекулярные пептидные, гликопротеиновые гормоны и их аналоги, запрещенные к использованию многими спортивными организациями. Интерес представляют два регуляторных пептида — ВИП и соматостатин. Первый, помимо того, что он вызывает снижение кровяного давления, расширения бронхов, усиливает работу пищеварительного тракта, является еще и активатором выброса большого количества других регуляторных пептидов. Второй, наоборот, угнетает выход многих пептидов, за что получил название «всеобщего ингибитора» или «пангибина». Другой замечательной особенностью пептидной регуляции является то обстоятельство, что многие физиологические функции практически одинаково изменяются под влиянием различных регуляторных пептидов. Так, известно несколько регуляторных пептидов, активирующих эмоциональное поведение (тиролиберин, меланостатин, кортиколиберин, β-эндорфин и др.). Многие регуляторные пептиды (РП) обладают способностью снижать кровяное давление ( ВИП, вещество Р, нейротензин и ряд других). Некоторые функции аминокислот в организме Основное количество аминокислот, поступивших из пищеварительного тракта в кровь, используется как пластический материал для синтеза белков в организме. Кроме этого, аминокислоты выполняют некоторые особые функции. Аминокислоты-медиаторы (медиатор – посредник). С помощью медиаторов осуществляется в нервной системе передача сигналов от одной клетки к другой. Они обеспечивают функционирование нервной системы. К группе медиаторов относятся такие аминокислоты, как глутаминовая, аспарагиновая, глицин. Аминокислоты-медиаторы участвуют в терморегуляции, деятельности сердечно-сосудистой системы, регуляции сна и бодрствования. Роль медиаторов выполняют и некоторые производные гистидина (гистамин) и триптофана (серотонин).
Поиск по сайту: |