 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Титриметрический анализ
МОДУЛЬ «ВВЕДЕНИЕ В ОБЩУЮ ХИМИЮ. ХИМИЯ И МЕДИЦИНА. ОСНОВЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА» Способы выражения концентрации растворов. Титриметрический анализ. 1. Раствор – это гомогенная система… 1) постоянного состава, состоящая из 2 и более независимых компонентов; 2) переменного состава, состоящая из 2 независимых компонентов; 3) переменного состава, состоящая из 2 и более независимых компонентов и продуктов их взаимодействия; 4) только постоянного состава, состоящая из 2 и более независимых компонентов и продуктов их взаимодействия. 2. Растворитель – это компонент, агрегатное состояние которого при образовании раствора: а) не изменяется; б) изменяется; в) концентрация которого в растворе больше; г) концентрация которого в растворе меньше. 1) б, в; 2) а, г; 3) а, в; 4) б, г. 3. Растворённое вещество – это компонент, агрегатное состояние которого при образовании раствора: а) не изменяется; б) изменяется; в) концентрация которого в растворе больше; г) концентрация которого в растворе меньше. 1) б, в; 2) а, б, г; 3) а, г; 4) а, в. 4. Концентрация вещества в растворе – это величина, измеряемая количеством растворённого вещества в определённом: а) объёме раствора; б) массе раствора; в) массе растворителя. 1) а; 2) а, б; 3) б; 4) а, б, в. 5. Дополните.В растворах электролитов вне зависимости от соотношения компонентов растворённым веществом считается _________________. 6. Плазмозамещающие растворы по медицинскому назначению делят на: а) гемодинамические; б) дезинтоксикационные; в) регуляторы водно-солевого баланса и кислотно-основного состояния; г) растворы для парентерального питания; д) переносчики кислорода; е) комплексные (полифункциональные). 1) все; 2) б, в, г, д; 3) а, д, е; 4) б, в, г, е. 7. Дополните.Для обеспечения энергоресурсов организма в медицине используют инфузионные растворы ________________________________. 8. Дополните. При интоксикации организма различной этиологии в инфузионно-трансфузионной терапии используют _______________ растворы. 9. Дополните. Моль – это единица _________________ вещества. 10. Массовая доля вещества Х в растворе, выраженная в % показывает, сколько: 1) граммов вещества содержится в 100 г раствора; 2) граммов вещества содержится в 100 мл раствора; 3) граммов вещества содержится в 1000 мл раствора; 4) граммов вещества содержится в 1 кг раствора. 11. Молярная концентрация вещества Х показывает, сколько: 1) моль вещества содержится в 100 мл раствора; 2) моль вещества содержится в 1 л раствора; 3) моль вещества содержится в 1 кг раствора; 4) моль вещества содержится в 1 кг растворителя. 12. молярная концентрация эквивалента вещества Х показывает, сколько: 1) моль вещества содержится в 1л раствора; 2) моль вещества содержится в 1кг раствора; 3) моль вещества эквивалента содержится в 1кг раствора; 4) моль вещества эквивалента содержится в 1л раствора. 13. эквивалент вещества – это: 1) реальная частица вещества, которая в данной реакции эквивалентна одному протону или одному электрону; 2) условная частица вещества, которая в данной реакции эквивалентна одному протону или одному электрону; 3) реальная или условная частица вещества, которая в данной реакции эквивалентна одному протону или одному электрону; 4) реальная частица вещества, которая эквивалентна только одному протону. 14. Эквивалент вещества может быть: 1) только реальной частицей вещества; 2) только условной частицей вещества; 3) реальной или условной частицей вещества; 4) все ответы неверны. 15. Фактор эквивалентности – это число, показывающее, какая доля: 1) реальной частицы вещества Х эквивалентна одному протону в кислотно-основной реакции или одному электрону в ОВР; 2) условной частицы вещества Х эквивалентна одному протону или одному электрону в данной реакции; 3) реальной или условной частицы вещества Х эквивалента одному протону или одному электрону в данной реакции; 4) все ответы неверны. 16. Фактор эквивалентности не может принимать значения: а) >1; б) <1; в) равное 1. 1) б; 2) б, в; 3) а; 4) а, б. 17. Фактор эквивалентности может принимать значения: а) >1; б) <1; в) равное 1. 1) а, б; 2) б, в; 3) а, б, в; 4) а, в. 18. Титр показывает, сколько: 1) граммов вещества содержится в 1 мл раствора; 2) граммов вещества содержится в 1л раствора; 3) граммов вещества содержится в 1 кг растворителя; 4) моль вещества содержится в 1л раствора. 19. Молярная концентрация вещества Х показывает, сколько: 1) моль вещества содержится в 100 мл раствора; 2) моль вещества содержится в 100 мл растворителя; 3) моль вещества содержится в 1кг растворителя; 4) моль вещества содержится в 1л растворителя. 20. Молярная масса эквивалента вещества Х – это: 1) масса 1 моль эквивалента вещества Х; 2) масса 1 моль вещества Х; 3) произведение количества вещества Х на его молярную массу; 4) отношение массы вещества Х к его количеству. 21. Молярная концентрация вещества Х и молярная концентрация эквивалента вещества Х имеют одно и то же численное значение, если фактор эквивалентности: 1) >1; 2) =1; 3) <1; 4) величина фактора эквивалентности не имеет значения. 22. Дополните.Предельно допустимая концентрация (ПДК) загрязняющих веществ – это ________________ содержание веществ в единице объёма воздуха или воды. 23. Дополните. Объёмное процентное содержание вещества в растворе показывает, сколько мл жидкого вещества содержится в _______ раствора. 24. Установите соответствие. Способ выражения концентрации вещества 1) массовая доля вещества Х 2) молярная концентрация вещества Х 3) Молярная концентрация эквивалента вещества Х 4) молярная доля вещества Х
Размерность в СИ А) моль/кг Б) безразмерная (доли единицы или %) В) моль/м3 Г) г/см3 25. Установите соответствие.
Способ выражения концентрации вещества 1) массовая доля вещества Х 2) титр вещества Х 3) титр по определяемому веществу А 4) молярная концентрация вещества Х
Математическое выражение А) Б) В) Г) Д) 26. Установите соответствие. Способ выражения концентрации вещества 1) молярная концентрация эквивалента вещества Х 2) молярная доля вещества Х 3) молярная концентрация вещества Х 4) массовая доля вещества Х
Математическое выражение А) Б) В) Г) Д)
27. К внесистемным единицам выражения состава раствора относится: а) молярная концентрация вещества Х; б) титр вещества Х; в) жёсткость воды; г) предельно допустимая концентрация загрязняющих веществ; д) молярная доля вещества. 1) все; 2) а, д; 3) б, в, г; 4) в, г. 28. Способу выражения концентрации вещества Х в растворе «массовая доля» не соответствует математическое выражение её: 1) 2) 3) 4) 29. Способу выражения концентрации вещества Х в растворе «молярная концентрация эквивалента» не соответствует математическое выражение её: 1) 2) 3) 4) 30. Способу выражения концентрации вещества Х в растворе «молярная концентрация» не соответствует математическое выражение её: 1) 2) 3) 4) 31. Изотонический раствор – это: 1) 0,89%-ный раствор NaCl; 2) 0,089%-ный раствор NaCl; 3) 8,9%-ный раствор NaCl; 4) 1,00%-ный раствор NaCl. 32. Запись «0,89%-ный раствор NaCl» означает, что: 1) в 100 г раствора содержится 0,89 г NaCl; 2) в 100 мл раствора содержится 0,89 г NaCl; 3) в 1л раствора содержится 0,89 г NaCl; 4) в 1кг раствора содержится 0,89 г NaCl. 33. Запись «3М раствор глюкозы» означает, что: 1) в 1л раствора содержится 3 моль глюкозы; 2) в 100 мл раствора содержится 3 моль глюкозы; 3) в 1кг раствора содержится 3 моль глюкозы; 4) в 100 г раствора содержится 3 моль глюкозы. 34. Запись «0,25 н. раствор H2SO4» означает, что: 1) в 1л раствора содержится 0,25 моль H2SO4; 2) в 1кг раствора содержится 0,25 моль эквивалента H2SO4; 3) в 1л раствора содержится 0,25 моль эквивалентаH2SO4; 4) в 1л растворителя содержится 0,25 моль H2SO4. 35. Фактор эквивалентности гидроксида алюминия в реакции Al (OH)3 + 3HCl=… равен: 1) 1/3; 2) ½; 3) 3; 4) 1/6. 36. Фактор эквивалентности гидроксида алюминия в реакции Al (OH)3 + 2HCl=… равен: 1) 1/3; 2) ½; 3) 1/6; 4) 2. 37. Фактор эквивалентности гидроксида алюминия в реакции Al (OH)3 + HCl=… равен: 1) 1/3; 2) ½; 3) 1/6; 4) 1. 38. Фактор эквивалентности гидроксида натрия в реакции H3PO4 + 3NaOH=… равен: 1) ½; 2) 1/3; 3) 1; 4) 3. 39. Фактор эквивалентности гидроксида натрия в реакции H3PO4 + 2NaOH=… равен: 1) ½; 2) 1; 3) 1/3; 4) 3. 40. Фактор эквивалентности гидроксида натрия в реакции H3PO4 + NaOH=… равен: 1) 1; 2) ½; 3) 1/3; 4) 2. 41. Фактор эквивалентности равен ½ в следующих схемах химических реакций: а) Fe (OH)3 + 3HCl=…; б) H2SO4 + 2NaOH=…; в) H2SO4 + NaOH=…; г) H2S + NaOH=…: 1) а, б; 2) в, г; 3) б, в, г; 4) б. 42. Фактор эквивалентности ортофосфорной кислоты в реакции H3PO4 + 3NaOH=… равен: 1) 1; 2) ½; 3) 1/3; 4) 2. 43. Фактор эквивалентности ортофосфорной кислоты в реакции H3PO4 + 2NaOH=… равен: 1) 1; 2) ½; 3) 1/3; 4) 2. 44. Фактор эквивалентности ортофосфорной кислоты в реакции H3PO4 + NaOH=… равен: 1) 1; 2) ½; 3) 1/3; 4) 2. 45. Фактор эквивалентности H2SO4 равен 1 в следующих схемах химических реакций: а) H2SO4 + NaOH=…; б) H2SO4 + 2NaOH=…; в) H2SO4 + Ca (OH)2=…; г) H2SO4 +Mg=…: 1) в, г; 2) а; 3) а, б; 4) б, в, г. 46. Фактор эквивалентности тетрабората натрия в реакции Na2B4O7 + 2HCl +5H2O=… равен: 1) 1; 2) 1/5; 3) ½; 4) 1/10. 47. Фактор эквивалентности перманганата калия в реакции KMnO4 + Na2SO3 + H2SO4=… равен: 1) 1; 2) 1/10; 3) ½; 4) 1/5. 48. Фактор эквивалентности перманганата калия в реакции KMnO4 + Na2SO4 + H2O=… равен: 1) 1/5; 2) 1/6; 3) 1/3; 4) ½. 49. Фактор эквивалентности перманганата калия в реакции KMnO4 + NaNO2 + NaOH=… равен: 1) 1; 2) ½; 3) 1/5; 4) 1/3. 50. Фактор эквивалентности щавелевой кислоты в реакции H2C2O4 + KMnO4 + H2SO4=… равен: 1) 1/10; 2) 1/5; 3) 5; 4) ½. 51. Фактор эквивалентности пероксида водорода в реакции KMnO4 + H2O2 + H2SO4=… равен: 1) 1/10; 2) 1/5; 3) ½; 4) 5. 52. Фактор эквивалентности вещества KMnO4 равен 1/5 в следующих схемах реакций: а) KMnO4 + H2SO4 + NaNO2=MnSO4 + NaNO3 + K2SO4 + H2O; б) KMnO4 + KOH + NaNO2=K2MnO4 + NaNO3 + H2O; в) KMnO4 + H2O + NaNO2=MnO2 + NaNO3 + KOH; г) KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O. 1) б, в; 2) а; 3) а, г; 4) а, в. 53. Фактор эквивалентности вещества KMnO4 равен 1/3 в следующих схемах реакций: 1) KMnO4 + H2SO4 + NaNO2=MnSO4 + NaNO3 + K2SO4 + H2O; 2) KMnO4 + KOH + NaNO2=K2MnO4 + NaNO3 + H2O; 3) KMnO4 + H2O + NaNO2=MnO2 + NaNO3 + KOH; 4) KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O. 54. Фактор эквивалентности вещества KMnO4 равен 1 в следующих схемах реакций: 1) KMnO4 + H2SO4 + NaNO2=MnSO4 + NaNO3 + K2SO4 + H2O; 2) KMnO4 + KOH + NaNO2=K2MnO4 + NaNO3 + H2O; 3) KMnO4 + H2O + NaNO2=MnO2 + NaNO3 + KOH; 4) KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O. 55. Фактор эквивалентности вещества KMnO4 не принимает значение 1/5 в следующих схемах реакций: 1) KMnO4 + NaOH + Na2SO3=K2MnO4 + Na2MnO4 + Na2SO4 + H2O; 2) KMnO4 + H2SO4 + Na2SO3=MnSO4 + K2SO4 + Na2SO4 + H2O; 3) KMnO4 + FeSO4 + H2SO4=MnSO4 + Fe2(SO4)3 + K2SO4 + H2O; 4) KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O. 56. Фактор эквивалентности вещества KMnO4 не принимает значение 1/3 в следующих схемах реакций: 1) KMnO4 + FeSO4 + H2SO4=MnSO4 + Fe2(SO4)3 + K2SO4 + H2O; 2) KMnO4 + N2O + H2SO4=MnSO4 + HNO3 + K2SO4 + H2O; 3) KMnO4 + H2O + Na2SO3=MnO2 + KOH + Na2SO4; 4) KMnO4 + C2H2 = K2C2O4 + MnO2 + KOH. 57. Установите соответствие. Схема ОВР 1) KMnO4 + N2O + H2SO4= MnSO4 + HNO3 + K2SO4 + H2O; 2) Mn (OH)4 + Br2 + KOH = K2MnO4 + KBr + H2O; 3) KMnO4 + KOH + NaNO2= K2MnO4 + NaNO3 + H2O; 4) Na [Cr (OH)4] + Cl2 + NaOH = Na2Cr2O4 + NaCl + H2O.
Значение фактора эквивалентности А) ¼; Б) 1/5; В) ½; Г) 1; Д) 1/3.
58. Установите соответствие.
Схема ОВР 1) KMnO4 + N2O + H2SO4=MnSO4 + HNO3 + K2SO4 + H2O; 2) K2CrO4 + KHSO3 + H2O = Cr (OH)3 + K2SO4 + KOH; 3) Na2SO3 + KI + H2SO4 = Na2S + I2+ K2SO4 + H2O; 4) NH3 + H2O2= N2+H2O.
Значение фактора эквивалентности А) ½ Б) ¼ В) 1 Г) 1/3 Д) 1/8 59. Молярная масса эквивалента Al (OH)3 (г/моль) в реакции Al (OH)3 + HCl = … равна: 1) 39; 2) 78; 3) 26; 4) 13. 60. Молярная масса эквивалента Al (OH)3 (г/моль) в реакции Al (OH)3 + 2HCl = … равна: 1) 39; 2) 78; 3) 26; 4) 13. 61. Молярная масса эквивалента Al (OH)3 (г/моль) в реакции Al (OH)3 + 3HCl = … равна: 1) 39; 2) 78; 3) 26; 4) 13. 62. Молярная масса эквивалента H3PO4 (г/моль) в реакции H3PO4+ NaOH = … равна: 1) 49; 2) 98; 3) 32,67; 4) 40. 63. Молярная масса эквивалента H3PO4 (г/моль) в реакции H3PO4+ 2NaOH = … равна: 1) 98; 2) 49; 3) 32,67; 4) 196. 64. Молярная масса эквивалента H3PO4 (г/моль) в реакции H3PO4+ 3NaOH = … равна: 1) 98; 2) 49; 3) 32,67; 4) 196. 65. Определить молярную массу эквивалента восстановителя (г/моль) в реакции: KI + H2SO4 (конц.)= I2 + H2S + K2SO4 + H2O. 1) 166; 2) 83; 3) 98; 4) 12,25. 66. Определить молярную массу эквивалента окислителя (г/моль) в реакции: KMnO4 + H2O2 + H2SO4 = O2 +... 1) 31,6; 2) 52,67; 3) 158; 4) 17. 67. Определить молярную массу эквивалента окислителя (г/моль) в реакции: KMnO4 + Na2SO3 + H2O = ... 1) 31,6; 2) 52,67; 3) 158; 4) 63. 68. Определить молярную массу эквивалента окислителя (г/моль) в реакции: KMnO4 + Na2SO3 + KOH = ... 1) 31,6; 2) 52,67; 3) 158; 4) 63. 69. Определить молярную массу эквивалента восстановителя (г/моль) в реакции: K2Cr2O7 + HCl = Cl2+CrCl3+KCl+H2O. 1) 49; 2) 18,25; 3) 6,08; 4) 36,5. 70. Определить молярную массу эквивалента восстановителя (г/моль) в реакции: CrCl3 + Br2 +KOH = KCl+K2CrO4+KBr+H2O. 1) 26,42; 2) 79,25; 3) 52,83; 4) 158,5. 71. Определить молярную массу эквивалента окислителя (г/моль) в реакции: KI + H2SO4 (конц.)= I2 + H2S + K2SO4 + H2O. 1) 83; 2) 98; 3) 166; 4) 12,25. 72. Определить молярную массу эквивалента окислителя (г/моль) в реакции: Cl2 + H2SO3= HCl + H2SO4 + H2O. 1) 49; 2) 98; 3) 24,5; 4) 35,5. 73. Определить молярную массу эквивалента восстановителя (г/моль) в реакции: KMnO4 + H2O2 + H2SO4 = O2 +... 1) 31,6; 2) 52,67; 3) 158; 4) 17. 74. Определить молярную массу эквивалента окислителя (г/моль) в реакции: CrCl3 + Br2 +KOH = KCl+K2CrO4+KBr+H2O. 1) 26,42; 2) 80; 3) 52,83; 4) 158,5. 75. Указать процесс, протекающий по схеме SO42-→SO32-: 1) восстановление; 2) окисление; 3) диспропорционирование; 4) ОВР не протекает. 76. Указать процесс, протекающий по схеме SO42-→SO2: 1) восстановление; 2) окисление; 3) диспропорционирование; 4) ОВР не протекает. 77. Указать процесс, протекающий по схеме AlO2-→Al: 1) восстановление; 2) окисление; 3) диспропорционирование; 4) ОВР не протекает. 78. Указать процесс, протекающий по схеме CrO42-→Cr3+: 1) восстановление; 2) окисление; 3) диспропорционирование; 4) ОВР не протекает. 79. Процесс окисления протекает в следующих схемах: а) CrO42-→Cr3+; б) Cl2→ClO3-; в) SO42-→H2S; г) H2C2O4→CO2: 1) б, г; 2) а, б; 3) б, в; 4) а, г. 80. Указать число электронов, принимающих участие в процессе NO2-→ NO3-. 1) 3; 2) 0; 3) 1; 4) 2.
81. Указать число электронов, принимающих участие в процессе Cl2→ClO3-: 1) 10; 2) 2; 3) 5; 4) 1. 82. Указать число электронов, принимающих участие в процессе Cr3+ → CrO42-: 1) 5; 2) 8; 3) 1; 4) 3. 83. Процесс восстановления не протекает в следующих схемах: а) Cr3+ → CrO42-; б) BrO3- → Br2; в) SO32-→ SO42-; г) NO3- → NO2-: 1) б, г; 2) а, в; 3) б, в; 4) а, г. 84. Указать частицы, принимающие участие в процессах: SO32-→ SO42-; BrO3- → Br2: 1) OH-, H2O; 2) H2O2, H2O; 3) OH-, H+; 4) H2O, OH-. 85. Указать частицы, принимающие участие в процессах: NO3- → NO2-; Br2 → BrO3-: 1) OH-, H2O; 2) H2O2, H2O; 3) OH-, H+; 4) H2O, H+. 86. Молекулы воды не принимаютучастия в следующих схемах процессов окисления или восстановления: а) Br2→BrO2- (щелочная среда); б) NO3-→NO2 (кислая среда); в) PH3→H3PO4 (кислая среда); г) ClO3-→Cl- (щелочная среда). 1) б, г; 2) а, б; 3) б, в; 4) а, г. 87. Молекулы воды не принимаютучастия в следующих схемах процессов окисления или восстановления: а) ClO3-→Cl- (щелочная среда); б) NO2-→ NO3- (щелочная среда); в) MnO2→MnO42- (щелочная среда); г) C2O42-→CO2. 1) а, г; 2) а, б; 3) б, в; 4) в, г. 88. Составить уравнение ОВР ионно-электронным методом и указать коэффициент у восстановителя KMnO4+KNO2+H2SO4→… 1) 2; 2) 5; 3) 10; 4) 7. 89. Составить уравнение ОВР ионно-электронным методом и указать сумму коэффициентов у восстановителя и окислителя K2Cr2O7+HCl → Cl2+CrCl3+KCl+H2O. 1) 14; 2) 1; 3) 15; 4) 6. 90. Составить уравнение ОВР ионно-электронным методом и указать коэффициент у восстановителя KI+H2SO4(конц.)→I2+H2S+K2SO4+ H2O. 1) 2; 2) 5; 3) 13; 4) 8. 91. Составить уравнение ОВР ионно-электронным методом и указать сумму коэффициентов у восстановителя и окислителя KMnO4+KNO2+H2SO4 → … 1) 5; 2) 7; 3) 10; 4) 2. 92. Составить уравнение ОВР ионно-электронным методом и указать сумму коэффициентов у восстановителя и окислителя K2Cr2O7+KI+H2SO4 → Cr2(SO4)3+I2+K2SO4+ H2O. 1) 6; 2) 13; 3) 7; 4) 14. 93. Укажите способы приготовления растворов: а) по навеске; б) из фиксаналов; в) разбавлением более концентрированного раствора. 1) а, б; 2) б, в; 3) а, б, в; 4) а, в. 94. В 20%-ном водном растворе этилового спирта указать растворитель: 1) этиловый спирт; 2) вода; 3) оба ответа верны; 4) оба ответа неверны. 95. В 80%-ном водном растворе этилового спирта указать растворитель: 1) этиловый спирт; 2) вода; 3) оба ответа верны; 4) оба ответа неверны. 96. Принцип работы ареометра основан на законе: 1) Паскаля; 2) Ньютона; 3) Эйнштейна; 4) Архимеда. 97. Раствор пероксида водорода требуемой концентрации можно приготовить следующим способом: 1) из фиксанала; 2) из навески; 3) разбавлением более концентрированного раствора; 4) всеми перечисленными методами. 98. Для приготовления 0,9%-ного раствора хлорида натрия не используютследующие способы приготовления растворов: а) из навески твёрдого вещества; б) из фиксанала; в) разбавлением более концентрированного раствора. 1) а, в; 2) б, в; 3) б; 4) в. 99. Установите правильную последовательность действий при приготовлении раствора заданного объема из фиксанала: 1) обмыть ампулу фиксанала и разбить бойком над воронкой в колбе; 2) добавить воду в колбу до метки и перемешать; 3) промыть ампулу через воронку в колбу; 4) выбрать мерную колбу в соответствии с требуемым объемом раствора; 5) перенести содержимое ампулы через воронку в мерную колбу. 100. Установите правильную последовательность действий при приготовлении вторичного стандартного раствора заданного объема из навески: 1) взвесить навеску на весах; 2) перенести навеску в мерную колбу требуемого объема; 3) сделать расчет навески; 4) стандартизировать вторичный стандартный раствор; 5) добавить воду в колбу до метки и перемешать. 101. Установите правильную последовательность действий при приготовлении первичного стандартного раствора заданного объема из навески: 1) Взвесить навеску на аналитических весах; 2) перенести навеску в мерную колбу требуемого объема; 3) сделать расчет навески; 4) добавить воду в колбу до метки и перемешать. 102. Установите правильную последовательность действий при приготовлении раствора с заданной молярной концентрацией способом разбавления концентрированного раствора: 1) отмерить необходимый объём концентрированного раствора цилиндром; 2) перенести концентрированный раствор в мерную колбу; 3) добавить воды в мерную колбу до метки и перемешать; 4) определить плотность концентрированного раствора с помощью ареометра; 5) сделать расчёт концентрированного раствора; 6) стандартизировать полученный раствор. 103. Установите правильную последовательность действий при приготовлении раствора с заданной массовой долей из концентрированного раствора: 1) отмерить необходимый объем концентрированного раствора цилиндром; 2) перенести концентрированный раствор в соответствующую химическую посуду; 3) добавить рассчитанный объем воды в соответствующую химическую посуду и перемешать; 4) определить плотность концентрированного раствора с помощью ареометра; 5) сделать расчет объема концентрированного раствора; 6) сделать расчет необходимого объема воды. 104. Для приготовления 200 г 0,9%-ного раствора хлорида натрия необходимо: 1) взвесить 0,9 г соли и добавить 199, 1 г дистиллированной воды; 2) взвесить 1,8 г соли и добавить 198, 2 г дистиллированной воды; 3) взвесить 9 г соли и добавить 191 г дистиллированной воды; 4) взвесить 18 г соли и добавить 182 г дистиллированной воды. 105. Титриметрический анализ – это: 1) метод количественного анализа, основанный на точном измерении объема раствора определяемого вещества; 2) метод качественного анализа, основанный на измерении объема раствора-титранта; 3) метод количественного анализа, основанный на точном измерении объема раствора реагента, необходимого для эквивалентного взаимодействия с определяемым веществом. 106. В основе титриметрического анализа лежит закон: 1) сохранения массы; 2) кратных отношений; 3) эквивалентов; 4) постоянства состава. 107. Титрование – это: 1) контролируемое добавление титранта к анализируемой системе; 2) добавление раствора анализируемого вещества к раствору известной концентрации; 3) произвольное приливание стандартного раствора в присутствии индикатора до изменения окраски; 4) только произвольное добавление стандартного раствора в присутствии индикатора до изменения окраски. 108. Классификация методов титриметрического анализа основана на: 1) применении определенного вида индикатора; 2) использовании конкретного способа титрования; 3) типах реакции, лежащих в основе определения; 4) применении определенного титранта. 109. В основе метода нейтрализации лежит реакция: 1) кислотно-основного взаимодействия; 2) окислительно-восстановительная; 3) осаждения; 4) комплексообразования. 110. В основе метода оксидиметрии лежит реакция: 1) кислотно-основного взаимодействия; 2) окислительно-восстановительная; 3) осаждения; 4) комплексообразования. 111. В основе метода осаждения лежит реакция: 1) комплексообразования; 2) нейтрализации; 3) окислительно-восстановительная; 4) образования малорастворимого вещества. 112. Определяемое вещество – это: 1) раствор реагента с точно известной концентрацией; 2) химический элемент, простое или сложное вещество, содержание которого определяют в образце; 3) устойчивое химически чистое соединение точно известного состава; 4) раствор реагента с неизвестной концентрацией. 113. Титрант – это: 1) раствор реагента с точно известной концентрацией; 2) устойчивое химически чистое соединение точно известного состава; 3) химический элемент, простое или сложное вещество, содержание которого определяют в образце; 4) раствор реагента с неизвестной концентрацией. 114. Установочное вещество – это: 1) раствор реагента с точно известной концентрацией; 2) простое или сложное вещество, содержание которого определяют в образце; 3) устойчивое химически чистое соединение точно известного состава; 4) раствор реагента с неизвестной концентрацией. 115. Укажите требование, которым должны удовлетворять установочные вещества: а) состав вещества должен строго соответствовать химической формуле; б) вещество должно быть химически чистым; в) вещество должно быть устойчивым как при хранении в твёрдом виде, так и в растворе; г) желательно возможно большая величина молярной массы эквивалента вещества: 1) все; 2) а, б, в; 3) а, в, г; 4) а, б, г. 116. Титрантами в методе нейтрализации являются: а) HCl; б) CH3COOH; в) NH4OH; г) NaOH: 1) а, б; 2) а, г; 3) б, в; 4) в, г. 117. Какие вещества являются установочными: а) H2SO4; б) HCl; в) Na2B4O7*10H2O; г) NaCl: 1) а, б; 2) б, в; 3) в, г; 4) а, г. 118. К установочным веществам в методе нейтрализации относятся: 1) Na2B4O7*10H2O; K2Cr2O7; 2) K2Cr2O7; NaCl; 3) H2C2O4*2H2O; NaCl; 4) Na2B4O7*10H2O; H2C2O4*2H2O. 119. К установочным веществам в методе перманганатометрии относятся: 1) H2C2O4*2H2O; Na2C2O4;(NH4)2C2O4; 2) K2Cr2O7; Na2CO3; NaCl; 3) H2C2O4*2H2O; Na2CO3; K2Cr2O7. 120. Титрантами в методе комплексометрии являются: 1) NaOH; 2) трилон Б; 3) K2Cr2O7; 4) (NH4)2C2O4. 121. К установочным веществам в методе перманганатометрии не относятся: 1) дихромат калия; 2) дигидрат щавелевой кислоты; 3) декагидрат тетрабората натрия; 4) оксалат натрия. 122. К установочным веществам в методе оксидиметрии не относятся: 1) дихромат калия; 2) трилон Б; 3) хлорид натрия; 4) дигидрат щавелевой кислоты. 123. Установите соответствие: Название метода 1) оксидиметрия 2) комплексометрия 3) метод осаждения 4) метод кислотно-основного титрования Формула установочного вещества А) K2Cr2O7 Б) KMnO4 Г) NaCl
124. К установочным веществам в методе кислотно-основного титрования не относятся: 1) дихромат калия; 2) декагидрат тетрабората натрия; 3) бромат калия; 4) хлорид натрия.
125. Установите соответствие: Реагенты 1) раствор аммиака раствором серной кислоты 2) раствор пероксида водорода раствором перманганата калия в кислой среде 3) раствор иода раствором тиосульфата натрия 4) раствор уксусной кислоты раствором гидроксида натрия Название индикатора
А) не применяется Б) фенолфталеин В) метилоранж Г) раствор крахмала Д) Раствор дихромата калия
126. Установите соответствие: Определяемые вещества 1) карбонат кальция 2) дихромат калия 3) сульфит натрия 4) хлорид аммония
Пары титрантов А) иод и тиосульфат натрия Б) иод и сульфат железа (II) В) соляная кислота и гидроксид натрия Г) перманганат калия и сульфат железа (II) Д) уксусная кислота и гидроксид аммония
127. Установите соответствие: Вторичный стандартный раствор 1) перманганат калия 2) нитрат серебра 3) иод 4) соляная кислота Первичный стандартный раствор А) тиосульфат натрия Б) соляная кислота В) Na2CO3*10H2O Г) Na2S2O3*5H2O
128. Для отбора проб используют следующие приёмы: а) метод пипетирования; б) метод отдельных навесок; в) титрование заместителя: 1) а; 2) а, б; 3) в; 4) б. 129. Какие способы титрования используют в титриметрическом анализе? 1) прямое; 2) обратное; 3) прямое, обратное, заместителя; 4) заместителя. 130. Прямое титрование – это: 1) непосредственное добавление титранта к определяемому веществу до состояния эквивалентности; 2) непосредственное добавление титранта к определяемому веществу до состояния нейтральности; 3) последовательное использование двух титрантов; 4) добавление к определяемому веществу избытка вспомогательного реагента и определение эквивалентного количества выделившегося продукта. 131. Обратное титрование – это: 1) непосредственное добавление титранта к определяемому веществу до состояния нейтральности; 2) добавление титранта к определяемому веществу до состояния эквивалентности; 3) последовательное использование двух титрантов, число моль эквивалентов определяемого вещества находят по разности числа моль эквивалентов дух титрантов; 4) определение числа моль эквивалентов определяемого вещества по числу моль эквивалентов дополнительного продукта. 132. Кривая титрования – это: 1) графическая зависимость рН среды от объема добавленного титранта; 2) зависимость рН среды от концентрации определяемого вещества; 3) графическая зависимость рН среды от концентрации определяемого вещества; 4) зависимость окраски раствора от объема добавленного титранта. 133. Скачок титрования – это: 1) резкое изменение рН среды в области точки нейтральности; 2) изменение рН среды от добавления небольшой порции титранта; 3) резкое изменение рН среды в области точки эквивалентности; 4) изменение окраски индикатора от добавления небольшой порции титранта. 134. Состояние эквивалентности – это: 1) изменение окраски индикатора вблизи точки нейтральности; 2) число моль эквивалента определяемого вещества равно числу моль эквивалента титранта; 3) рН среды должно быть равно 7; 4) совпадение точек нейтральности и эквивалентности. 135. Правило выбора индикатора: 1) интервал перехода его окраски должен совпадать с точкой нейтральности; 2) интервал перехода его окраски должен совпадать со скачком титрования; 3) изменение окраски индикатора должно совпадать с линией нейтральности; 4) интервал изменения окраски индикатора должен совпадать с точкой эквивалентности. 136. Индикатор – это: а) вещество, необходимое для опредеоения конца титрования; б) сложная органическая кислота или основание; в) вещество, участвующее в реакции, вызывающее заметные на глаз изменения в состоянии эквивалентности: 1) а; 2) б, в; 3) а, б; 4) а, в. 137. Интервал перехода окраски индикатора в кислотно-основном титролвании используют для: 1) определения состояния эквивалентности; 2) определения рН в точке эквивалентности; 3) выбора индикатора; 4) определения объёма титранта. 138. Точность титриметрического анализа зависит от: а) точности измерения объема реагирующих веществ; б) правильности и точности приготовления титрантов; в) правильного выбора индикатора и его чувствительности: 1) а, в; 2) а, б; 3) б, в; 4) а, б, в. 139. Титрование раствора аммиака сильной кислотой можно проводить в присутствии индикатора: 1) фенолфталеина; 2) метилоранжа; 3) фенолфталеина и метилоранжа; 4) лакмуса. 140. Титрование уксусной кислоты сильным основанием можно проводить в присутствии индикатора: 1) фенолфталеина; 2) фенолфталеина и метилоранжа; 3) метилоранжа; 4) метилрота. 141. Титрование сильной кислоты сильным основанием можно проводить в присутствии индикатора: 1) фенолфталеина; 2) фенолфталеина и метилоранжа; 3) метилоранжа; 4) тимолфталеина. 142. На кривой титрования слабой кислоты сильным основанием: 1) точка эквивалентности не совпадает с точкой нейтральности; 2) точка эквивалентности смещена в кислую область; 3) скачок титрования находится в диапазоне рН 4-6; 4) точка эквивалентности совпадает с точкой нейтральности. 143. На кривой титрования сильной кислоты сильным основанием: 1) точка эквивалентности соответствует рН=7; 2) точка эквивалентности не совпадает с точкой нейтральности; 3) скачок титрования находится в диапазоне рН 4-6; 4) точка эквивалентности смещена в щелочную область. 144. На кривой титрования слабого основания сильной кислотой: 1) точка эквивалентности совпадает с точкой нейтральности; 2) точка эквивалентности смещена в кислую область; 3) скачок титрования находится в диапазоне рН 6-8; 4) точка эквивалентности смещена в щелочную область. 145. Определяемые вещества в методе нейтрализации – это: а) слабая и сильная кислоты; б) слабое и сильное основания; в) соли, подвергающиеся гидролизу; г) только сильные кислоты и основания: 1) а, б; 2) а, б, в; 3) в, г; 4) г. 146. Кислотно-основные индикаторы должны соответствовать следующим требованиям: а) окраска индикатора должна быть интенсивной и различаться в кислой и щелочной средах; б) изменение окраски должно быть быстрым, чётким и обратимым; в) окраска индикатора должна меняться в узком интервале изменения рН раствора; г) индикатор должен быть чувствительным и менять свою окраску в присутствии минимального избытка кислоты или щелочи; д) индикатор должен быть стабильным, не разлагаться в водном растворе и на воздухе: 1) а, б, в, г; 2) все; 3) б, в, г, д; 4) а, б, г. 147. Для стандартизации раствора HCl используют: а) буру; б) гидрокарбонат натрия; в) Na2CO3*10H2O; г) гидроксид натрия. 1) а; 2) б, в; 3) а, в; 4) в, г. 148. Для стандартизации раствора перманганата калия используют: 1) карбонат натрия; 2) H2C2O4*2H2O; 3) хлорид натрия; 4) бура. 149. В оксидиметрии индикаторами являются: а) избыток перманганата калия; б) крахмал; в) трилон Б; г) метилрот. 1) а; 2) б, в; 3) в, г; 4) а, б. 150. Пероксид водорода в перманганатометрии проявляет свойства: 1) окислительные; 2) диспропорционирует; 3) восстановительные; 4) ОВ свойства не проявляет. 151. Для определения состояния эквивалентности в перманганатометрии используют индикатор: 1) метилоранж; 2) фенолфталеин; 3) избыток раствора перманганата калия; 4) лакмус. 152. Для создания среды в перманганатометрии используют кислоты: 1) соляную, серную; 2) серную; 3) азотную, уксусную; 4) соляную. 153. Титрантами в методе оксидиметрии являются: а) перманганат калия; б) сероводород; в) гидроксид натрия; г) дихромат калия: 1) а, б; 2) б, в; 3) а, г; 4) в, г. 154. Перманганатометрию проводят в среде: 1) сильнокислой; 2) нейтральной; 3) сильнощелочной; 4) щелочной. 155. Для созданиякислой среды в перманганатометрии не используют соляную кислоту, т. к. она: 1) проявляет восстановительные свойства; 2) проявляет окислительные свойства; 3) слабая кислота; 4) летучая кислота.
Ответы
Поиск по сайту: |
 ;
; ;
; ;
; ;
; .
. ;
; ;
; ;
; ;
;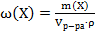 ;
; .
.
 ;
;