 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ПЛАСТОВЫЕ ГАЗЫ, КОНДЕНСАТЫ, ГАЗОГИДРАТЫ
Природные углеводородные газы представляют собой смесь предельных УВ вида СпН2п+2. Основным компонентом является метан СН4. Наряду с метаном в состав природных газов входят более тяжелые УВ, а также неуглеводородные компоненты: азот N, углекислый газ СО2, сероводород H2S, гелий Не, аргон Аг. Природные газы подразделяют на следующие группы. 1. Газ чисто газовых месторождений, представляющий собой сухой газ, почти свободный от тяжелых УВ. 2. Газы, добываемые из газоконденсатных месторождений, — смесь сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат состоит из С5+высш. 3. Газы, добываемые вместе с нефтью (растворенные газы). Это физические смеси сухого газа, пропан-бутановой фракции (жирного газа) и газового бензина. Компонентный состав природного газа трех месторождений приведен в табл. 5.
Таблица 5 Компонентный состав, % по объему, газов некоторых месторождений
Газ, в составе которого УВ (С3, С4) составляют не более 75 г/м3, называют сухим. При содержании более тяжелых УВ (свыше 150 г/м3) газ называют жирным. Газовые смеси характеризуются массовыми или молярными концентрациями компонентов. Для характеристики газовой смеси необходимо знать ее среднюю молекулярную массу, среднюю плотность или относительную плотность по воздуху. Молекулярная масса природного газа
где Для реальных газов обычно М = 16-20. Плотность газа рг рассчитывается по формуле
Где Обычно значение рг находится в пределах 0,73-1,0 кг/м3.Чаще пользуются относительной плотностью газа по воздуху
Если рг и рв определяются при стандартных условиях, то Уравнения состояния газовиспользуются для определения многих физических свойств природных газов. Уравнением состояния называется аналитическая зависимость между давлением, объемом и температурой. Состояние газов в условиях высоких давления и температуры определяется уравнением Клайперона - Менделеева: pV = NRT, где р — давление; V - объем идеального газа; N – число киломолей газа; R — универсальная газовая постоянная; Г — температура. Эти уравнения применимы для идеальных газов. Идеальным называется газ, силами взаимодействия между молекулами которого пренебрегают. Реальные углеводородные газы не подчиняются законам идеальных газов. Поэтому уравнение Клайперона - Менделеева для реальных газов записывается в виде pV = ZNRT, (VI.9) где Z — коэффициент сверхсжимаемости реальных газов, зависящий от давления, температуры и состава газа и характеризующий степень отклонения реального газа от закона для идеальных газов. Коэффициент сверхсжимаемостиZ реальных газов — это отношение объемов равного числа молей реального V и идеального Vн газов при одинаковых термобарических условиях (т.е. при одинаковых давлении и температуре): Z = V/Vн (VI. 10) Значения коэффициентов сверхсжимаемости наиболее надежно могут быть определены на основе лабораторных исследований пластовых проб газов. При отсутствии таких исследований прибегают к расчетному методу оценки Z по графику Г. Брауна (см. рис. 38). Для пользования графиком необходимо знать так называемые приведенные псевдокритическое давление и псевдокритическую температуру. Суть этих понятий состоит в следующем. Объем углеводородных газов меняется в зависимости от температуры и давления примерно в соответствии с рис. 39. Каждая из кривых соответствует фазовым изменениям однокомпонентного газа при постоянной температуре и имеет три участка. Отрезок справа от пунктирной линии соответствует газовой фазе, участок под пунктирной линией двухфазной газожидкостной области и отрезок слева от пунктирной линии - жидкой фазе. Отрезок пунктирной кривой вправо от максимума в точке С называется кривой точек конденсации (точек росы), а влево от максимума — кривой точек парообразования. Точка С называется критической. Значения давления и температуры, соответствующие критической точке С, также называются критическими. Другими словами, критической называется такая температура, выше которой газ не может быть превращен в жидкость ни при каком давлении. Критическим давлением называется давление, соответствующее критической точке перехода газа в жидкое состояние.
Рис. 39. Диаграмма фазового состояния чистого этана (по Ш.К. Гиматудинову): v – удельный объем, р - давление
С приближением значений давления и температуры к критическим свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются. С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают особенности, отличающие их поведение от поведения однокомпонентного газа. Не останавливаясь на подробностях, следует отметить, что критическая температура смеси находится между критическими температурами компонентов, а критическое давление смеси всегда выше, чем критическое давление любого компонента. Для определения коэффициента сверхсжимаемости Z реальных газов, представляющих собой многокомпонентную смесь, находят средние из значений критических давлений и температур каждого компонента. Эти средние называются псевдокритическим давлением рпкр и псевдокритической температурой Tпкр. Они определяются из соотношений:
Где Приведенные псевдокритические давление и температура, необходимые для пользования графиком Брауна, представляют собой псевдокритические значения, приведенные к конкретным давлению и температуре (к пластовым, стандартным или каким-либо другим условиям):
где p и T — конкретные давление и температура, для которых определяется Z. Если состав газа неизвестен, то его псевдокритические давление и температуру определяют по графикам (рис. 40). В том случае, когда в газе содержатся H2S, N2 и С02, в значения, снятые с этих графиков, вводят поправки с соответствующим знаком. Если неуглеводородных компонентов в газе более 15 %, графиками на рис. 40 пользоваться не рекомендуется. Коэффициент сверхсжимаемости Z обязательно используется при подсчете запасов газа, прогнозировании изменения давления в газовой залежи и решении других задач. Влагосодержание природных газовсвязано с тем, что природные газы и газоконденсатные смеси контактируют с пластовыми водами различных форм и видов (см. раздел 4 настоящей главы), вследствие чего содержат определенное количество паров воды. Концентрация водяных паров в газе зависит от его состава, давления, температуры. Отношение количества водяных паров (в долях единицы или процентах), находящихся в газе, к максимально возможному содержанию водяных паров в том же газе при тех же условиях называют относительной влажностью газа. Она характеризует степень насыщения газа водяным паром. Количество водяных паров, находящихся в единице объема или массы газа (г/м3 или г/кг), называют абсолютной влажностью.
Рис. 40. Графики зависимости псевдокритических давлениярпкр(а) и температурыTпкр(б) от плотности углеводородных газов по воздуху Месторождения: 1 — газовые, 2 — газоконденсатные; поправки, %, к величинам псевдокритических давления Δр и температуры ΔT за счет содержания: 3 – N2, 4 – СО2, 5 – H2S
Пары воды, присутствующие в газах и газоконденсатных смесях, влияют на фазовые превращения углеводородных систем. При определенных термодинамических условиях вода может выделяться из газа (конденсироваться), т.е. переходить в капельножидкое состояние. В газоконденсатных системах могут одновременно выделяться вода и конденсат. В присутствии воды давление начала конденсации УВ увеличивается. Объемный коэффициент пластового газа bг, представляющий собой отношение объема газа в пластовых условиях
Значение величины bгимеет большое значение, так как объем газа в пластовых условиях на два порядка (примерно в 100 раз) меньше, чем в стандартных условиях. Конденсатомназывают жидкую углеводородную фазу, выделяющуюся из газа при снижении давления. В пластовых условиях конденсат обычно весь растворен в газе. Различают конденсат сырой и стабильный. Сырой конденсатпредставляет собой жидкость, которая выпадает из газа непосредственно в промысловых сепараторах при давлении и температуре сепарации. Он состоит из жидких при стандартных условиях УВ, т.е. из пентанов и высших (С6+высш), в которых растворено некоторое количество газообразных УВ-бутанов, пропана и этана, а также H2S и других газов. Важной характеристикой газоконденсатных залежей является конденсатно-газовый фактор,показывающий содержание сырого конденсата (см3) в 1 м3 отсепарированного газа. На практике используется также характеристика, которая называется газоконденсатным фактором, — это количество газа (м3), из которого добывается 1 м3 конденсата. Значение газоконденсатного фактора колеблется для разных месторождений от 1500 до 25 000 м3/м3. Стабильный конденсатсостоит только из жидких УВ — пентана и высших (С6+высш). Его получают из сырого конденсата путем дегазации последнего. Температура выкипания основных компонентов конденсата находится в диапазоне 40-200 "С. Молекулярная масса 90-160. Плотность стабильного конденсата в стандартных условиях изменяется от 0,6 до 0,82 г/см3 и находится в прямой зависимости от компонентного углеводородного состава. Газы газоконденсатных месторождений делятся на газы с низким содержанием конденсата (до 150 см3/м3), средним (150-300 см3/м3), высоким (300-600 см3/м3) и очень высоким (более 600 см3/м3). Большое значение имеет такая характеристика газа конденсатных залежей, как давление начала конденсации,т.е. давление, при котором конденсат выделяется в пласте из газа в виде жидкости. Если при разработке газоконденсатной залежи в ней не поддерживать давление, то оно с течением времени будет снижаться и может достигнуть величины меньше давления начала конденсации. При этом в пласте начнет выделяться конденсат, что приведет к потерям ценных УВ в недрах. Это надо учитывать при подсчете запасов и определении показателей проектов разработки. Исследования газоконденсатных залежей нужно производить с самого начала освоения залежи. При этом необходимо устанавливать: · состав пластового газа и содержание в нем конденсата; · давление начала конденсации УВ в пласте и давление максимальной конденсации; · фазовое состояние конденсатной системы в пластовых условиях; · количество и состав конденсата, выделяющегося из 1 м3 газа при различных давлениях и температуре; · возможные потери конденсата в недрах при разработке залежи без поддержания пластового давления в зависимости от степени падения давления; · фазовые превращения и свойства газоконденсатных смесей в стволах скважин, газосепараторах и газопроводах. О свойствах газа и газоконденсата в пластовых условиях обычно судят на основании данных об их свойствах в стандартных условиях и расчетов без отбора и анализа глубинных проб газа. Основой таких расчетов являются результаты моделирования фазовых превращений углеводородной смеси в лабораторных установках. Однако следует учитывать, что этот метод недостаточно точен. Гидраты газовпредставляют собой твердые соединения (клатраты), в которых молекулы газа при определенных давлении и температуре заполняют структурные пустоты кристаллической решетки, образованной молекулами воды с помощью водородной связи. Молекулы воды как бы раздвигаются молекулами газа — плотность воды в гидратном состоянии возрастает до 1,26-1,32 см3/г (плотность льда 1,09см3/г). Один объем воды в гидратном состоянии связывает в зависимости от характеристики исходного газа от 70 до 300 объемов газа. Условия образования гидратов определяются составом газа, состоянием воды, внешними давлением и температурой и выражаются диаграммой гетерогенного состояния в координатах р–T(рис. 41). Для заданной температуры повышение давления выше давления, соответствующего равновесной кривой, сопровождается соединением молекул газа с молекулами воды и образованием гидратов. Обратное снижение давления (или повышение температуры при неизменном давлении) сопровождается разложением гидрата на газ и воду. Плотность гидратов природных газов составляет от 0,9 до 1,1 г/см3.
1 — N2, 2 — СН4,3 — СО2; природная газовая смесь с относительной плотностью по воздуху: 4 — 0,6; 5 — 0,8; 6 – С2Н6; 7 – С3Н8; 8 – Н2S. Газогидратные залежи— это залежи, содержащие газ, находящийся частично или полностью в гидратном состоянии (в зависимости от термодинамических условий и стадии формирования). Для формирования и сохранения газогидратных залежей не нужны литологические покрышки: они сами являются непроницаемыми экранами, под которыми могут накапливаться залежи нефти и свободного газа. Газогидратная залежь внизу может контактировать с пластовой подошвенной водой, газовой залежью или непроницаемыми пластами. Присутствие гидратов в разрезе можно обнаружить стандартными методами каротажа. Гидратсодержащие пласты характеризуются: ü незначительной амплитудой ПС; ü отсутствием или малым значением приращения показаний микроградиент - зонда; ü интенсивностью вторичной α-активности, близкой к интенсивности водонасыщенных пластов; ü отсутствием глинистой корки и наличием каверн; ü значительной (в большинстве случаев) величиной рк; ü повышенной скоростью прохождения акустических волн и др. В основе разработки газогидратных залежей лежит принцип перевода газа в залежи из гидратного состояния в свободное и отбора его традиционными методами с помощью скважин. Перевести газ из гидратного состояния в свободное можно путем закачки в пласт катализаторов для разложения гидрата; повышения температуры залежи выше температуры разложения гидрата; снижения давления ниже давления разложения гидрата; термохимического, электроакустического и других воздействий на газогидратные залежи. При вскрытии и разработке газогидратных залежей необходимо иметь в виду их специфические особенности, а именно: резкое увеличение объема газа при переходе его в свободное состояние; постоянство пластового давления, соответствующего определенной изотерме разработки газогидратной залежи; высвобождение больших объемов воды при разложении гидрата и др.
Поиск по сайту: |
 (VI.6)
(VI.6) 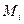 — молекулярная масса i-го компонента;
— молекулярная масса i-го компонента; 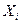 — объемное содержание i-го компонента, доли ед.
— объемное содержание i-го компонента, доли ед.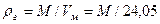 (VI.7)
(VI.7)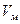 объем 1 моля газа при стандартных условиях.
объем 1 моля газа при стандартных условиях.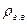 , равной отношению плотности газа
, равной отношению плотности газа 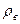 к плотности воздуха рв, взятой при тех же давлении и температуре:
к плотности воздуха рв, взятой при тех же давлении и температуре: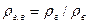 (VI.8)
(VI.8)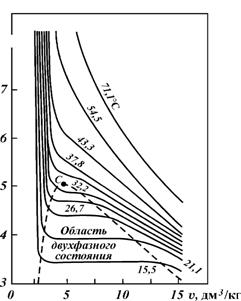
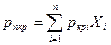 (VI. 11)
(VI. 11)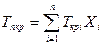 (VI. 12)
(VI. 12) и
и  - критические давление и температура i-го компонента;
- критические давление и температура i-го компонента; 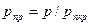 (VI. 13)
(VI. 13)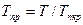 (VI. 14)
(VI. 14)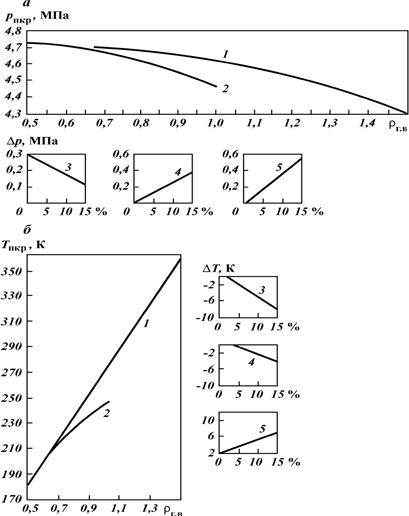
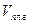 к объему того же количества газа Vст, который он занимает в стандартных условиях, можно найти с помощью уравнения Клайперона - Менделеева:
к объему того же количества газа Vст, который он занимает в стандартных условиях, можно найти с помощью уравнения Клайперона - Менделеева: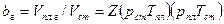 (VI. 15)
(VI. 15) — давление и температура соответственно в пластовых и стандартных условиях.
— давление и температура соответственно в пластовых и стандартных условиях.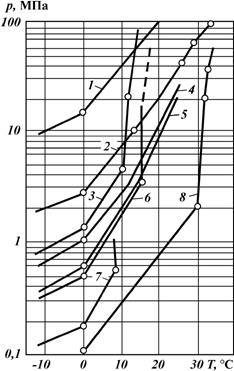 Рис. 41. Диаграмма гетерогенного состояния газов (по Ю.Ф. Макогону):
Рис. 41. Диаграмма гетерогенного состояния газов (по Ю.Ф. Макогону):