 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Механизм движения ионов. Абсолютная скорость ионовСтр 1 из 2Следующая ⇒
Растворы электролитов. Теория электрической диссоциации. Электролиты – вещества, которые в растворе или расплаве полностью или частично состоят из ионов. Данные вещества способны проводить электрический ток. Теория Аринуса:1)При растворении в воде молекулы электролитов распадаются на катионы и анионы, что приводит изменению энергии Гиббса. Для количественной характеристики электролитов была введена степень диссоциации: Характеристикой слабых электролитов является константа диссоциации:
Изотонический коэффициент – отношение фактического числа частиц в растворе, к тому, которое было бы без диссоциации.
Сильные электролиты. ü В растворах полностью диссоциируют на ионы; ü Между ионами существует электростатическое взаимодействие – каждый ион окружён обратно заряженными ионами, так называемой ионной атмосферой. Для растворов сильных электролитов используют активности, а не концентрации.
Коэффициент активности ( Для сильных электролитов нужно учитывать силы электростатического взаимодействия между ионами, т.к. происходит уменьшение скорости движения ионов из-за двух эффектов: 1)Катоффетический – торможение ионов при движении из-за наличия ионной атмосферы. 2)Релаксационный – разрушение старой ионной атмосферы и образование новой.
Механизм движения ионов. Абсолютная скорость ионов. Для включения электрического поля ионы хаотично движутся,а при наложении поля одно из направлений преобладает,и движение от А к К.По мере увеличения скор.движения возрастает сопротивление среды,оно больше,чем больше вязкость среды и радиус иона.Абсолютная скорость движения ионов равна скорости движения иона при напряжённости электрич.поля = 1 вольт/м2.По мере уменьш. концентрации возрастает число ионов в р-ре. Движение ионов возникает из-за: 1) неодинакового распределения ионов по обе стороны мембраны; 2) избирательной проницаемости мембраны для ионов. В состоянии покоя мембрана неодинаково проницаема для различных ионов.
Поиск по сайту: |
 . 2)Процесс диссоциации обратим, т.е. в растворе существует равновесие. А при разбавлении возможна полная диссоциация.
. 2)Процесс диссоциации обратим, т.е. в растворе существует равновесие. А при разбавлении возможна полная диссоциация. 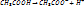 . 3)Сумма катионов равна сумме анионов. 4)Растворы ведут себя, как идеальные газы (истинно только для растворов слабых электролитов).
. 3)Сумма катионов равна сумме анионов. 4)Растворы ведут себя, как идеальные газы (истинно только для растворов слабых электролитов). - число продиссоциированных молекул;
- число продиссоциированных молекул;  - общее число молекул в растворе; По степени диссоциации различают сильные (
- общее число молекул в растворе; По степени диссоциации различают сильные (  =1, диссоциация проходит полностью) и слабые (
=1, диссоциация проходит полностью) и слабые (  электролиты.
электролиты. Связь между
Связь между  и
и  . Растворы электролитов значительно отличаются от идеальных растворов тем, что происходит увеличение частиц в результате диссоциации.
. Растворы электролитов значительно отличаются от идеальных растворов тем, что происходит увеличение частиц в результате диссоциации. Связь между
Связь между  и
и  :
:  K – суммарное число ионов, образующихся в процессе диссоциации 1 молекулы электролита.
K – суммарное число ионов, образующихся в процессе диссоциации 1 молекулы электролита.
 ) – мера отличия свойств растворов электролитов от свойств идеальных растворов.
) – мера отличия свойств растворов электролитов от свойств идеальных растворов.