 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Короткі відомості про будову атомів
Відомо, що атом будь-якої речовини складається із позитивно зарядженого ядра і системи електронних оболонок, по яких рухаються електрони. Ядро утворюють протони і нейтрони, в ньому зосереджена практично вся маса атома. Протони мають позитивний електронний заряд, електрони – негативний, що дорівнює за величиною заряду протона. Нейтрони – електрично нейтральні і їх заряд дорівнює нулеві. У нормальному стані атом має однакову кількість протонів і електронів, а тому є електрично нейтральним.
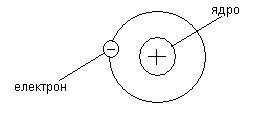
Рис.1. Схема будови атома водню
Кількість протонів, нейтронів і електронів у атомі залежить від хімічного елемента, складовою частиною якого він є. Так, наприклад, в атомі водню навколо ядра обертається тільки один електрон (рис. 1). Кількість електронів, що обертається навколо ядра, завжди дорівнює порядковому номеру елемента в Періодичній системі елементів Менделєєва. Електрони, розташовані на зовнішніх орбітах, зв’язані з ядром слабкіше тих, що на внутрішніх орбітах. Тому під впливом сусідніх атомів або внаслідок інших причин зовнішні електрони можуть залишити свою орбіту, що призводить до зміни електричного стану атома. Електрони, які розміщуються на зовнішніх орбітах, називають валентними. Вони визначають хімічну активність речовини, тобто беруть участь у створенні хімічного зв’язку між атомами. Електрони, які звільнилися від зв’язку з атомами, називаються вільними.Вони пересуваються всередині речовини між атомами в різних напрямках і з різними швидкостями. При зовнішньому електричному полі хаотичний рух електронів стає впорядкованим – виникає електричний струм. Чим більше вільних електронів має речовина, тим вища її електропровідність. Нейтральний в електричному відношенні атом може втратити або набути електрони. Такий заряджений атом називають іоном. Процес відривання електрона від атома або приєднання до атома зайвих електронів, внаслідок чого створюється негативний або позитивний іон, називається іонізацієюатомів. Іони, що мають різноманітні заряди, притягуючись один до одного, створюють молекули. Описана вище так звана класична теорія будови атомів (модель Резерфорда) не дає відповіді на ряд питань, пов’язаних з властивостями частинок, розташованих всередині атома. Більш повне уявлення про властивості цих частинок дає квантова теорія, згідно якій електрони мають властивості не тільки матеріальних частинок (корпускул), а й хвильові.
2.2 Основні положення квантової теорії будови атома: Гіпотеза М. Планка.В 1900р. М. Планк висунув гіпотезу: енергія електронів в атомі може приймати тільки відповідні дискретні значення. Зміна енергії може проходити тільки стрибкоподібно. Постулати Н. Бора.В 1913 р. Н. Бор встановив наступне: 1. Електрон в атомі може знаходитися у відповідних стійких станах, що називаються стаціонарними. В цьому випадку атом не випромінює енергії. 2. Атом випромінює або поглинає енергію тільки при переході із одного стаціонарного стану в інший. Величина порції (кванта) енергії зв’язана з частотою випромінювання виразом: W = hν, (1) де h – постійна Планка (h = 6,26 ν– частота випромінювання. 3. Момент кількості руху електрона на стаціонарній орбіті повинен бути кратним числу h/ 2p meV де me – маса електрона; V – швидкість руху електрона по орбіті; r – радіус орбіти електрона; n – ціле число. Гіпотеза де Бройля.В 1923 р. Луї де Бройль висунув припущення про наявність хвильових властивостей у рухомих частинах взагалі і зокрема в електронах. Не випромінюється електромагнітна енергія зарядженої частинки, що рухається по замкнутій орбіті, тільки тоді, коли вздовж орбіти укладається ціле число хвиль, тобто утворюється стояча хвиля. Отже, при русі по орбіті з радіусом r має виконуватися співвідношення:
де l - довжина хвилі;n – ціле число (1, 2, 3, ...). Довжину хвилі електрона, у якого маса m0 і швидкість V, можна визначити, якщо прирівняти його енергії – механічну і зумовлену хвильовими властивостями: hν= h (V / λ) = (meV2) / 2 (4) Звідки λ = 2h / (meV) (5) Число n у рівнянні (3) називають головним квантовим числом.Воно визначає орбіту електрона, яку він може займати відповідно до рівня енергії. Принцип невизначеності В. Гейзенберга.Згідно цього принципу в атомній системі неможливо одночасно точно задати координати і швидкість електрона. Якщо при визначенні координати х неточність буде рівна Δх, а неточність у визначеності відповідної координати швидкості Vx буде ΔVx, то співвідношення Гейзенберга для цієї компоненти матиме вигляд ΔVx ΔX»h (6) Таким чином, чим точніше задати координату х (ΔX→0), тим більше невизначеною буде величина Vx(ΔVx≈ (h/ΔX)→∞), і навпаки. Звідси виходить, що поняття траєкторії по відношенню до внутрішніх атомних переміщень електрона, а також представлення його як матеріальну частинку являються недостатніми. Крім головного квантового числа, стан електрона характеризується ще трьома квантовими числами: орбітальним, що визначає малу вісь еліптичної орбіти електрона; орбітальним магнітним, яким визначають орієнтацію орбіти в просторі, та спіновим магнітним – для визначення обертання електрона навколо осі, перпендикулярної до площини орбіти. Принцип Паулі. Згідно цього принципу жодні два електрони в атомі не можуть мати чотирьох однакових квантових чисел. Спінове магнітне квантове число може мати тільки два значення: ± ½.
Поиск по сайту: |
 10-34 Дж
10-34 Дж 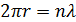 , (3)
, (3)