 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Расчеты и анализ результатов опыта
Химическое равновесие»
Минск 2012 Цель работы: изучить влияние различных факторов на скорость и равновесие физико-химических процессов. Экспериментальная часть 1. Зависимость скорости реакции от концентрации реагирующих веществ Ход и данные опыта Для наблюдения зависимости скорости реакции от концентрации реагирующих веществ используем реакцию взаимодействия раствора иодата калия KIO3 (раствор А) с раствором сульфита натрия Na2SO3 (раствор Б) в присутствии серной кислоты и крахмала (индикатора на свободный йод):
или в ионной форме
Реакция проводится при постоянной температуре (комнатной), постоянной концентрации иодата калия и переменной концентрации сульфита натрия. Приготовим раствор Б различных концентраций в соответствии с табл.1. Поместим в одну пробирку 20 капель раствора А, в другую-20 капель раствора Б. Сольем содержимое пробирок и отметим время появления признака реакции (синей окраски).Затем в аналогичном порядке выполним остальные варианты опытов и данные внесем в табл. 1. Вычислим относительную скорость реакции (1/t, с-1) и занесем в табл. 1.
Расчеты и анализ результатов опыта 1. Начертим график зависимости скорости реакции от концентрации реагирующих веществ, откладывая по оси абсцисс относительную концентрацию раствора сульфита натрия, по оси ординат – относительную скорость реакции.
Рисунок 1. ____________________________________________________
2. Объясните, почему при повышении концентрации сульфита натрия изменяется (увеличивается или уменьшается) скорость исследуемой реакции? С чем это связано? _____________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 3. Какой кинетический закон устанавливает зависимость скорости реакции от концентрации реагирующих веществ? Запишите его выражение для исследуемой реакции. Подтверждает ли полученный в опыте результат выполнение этого закона для исследуемой реакции?_______________________ _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 1.3. Вывод (о влиянии концентрации веществ на скорость реакции). ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Зависимость скорости реакции от температуры Ход и данные опыта Для изучения зависимости скорости реакции от температуры использовали реакцию окисления щавелевой кислоты (H2C2O4) перманганатом калия (KMnO4) в присутствии серной кислоты. Уравнение реакции имеет вид
или в ионной форме
Реакция проводилась при постоянной концентрации реагирующих веществ и переменной температуре (табл. 2.). Поместим в 4 пробирки по 20 капель раствора щавелевой кислоты, в другие 4 пробирки поместим по 20 капель KMnO4 и 20 капель концентрированной H2SO4. Нагреем содержимое пробирок до температур, указанных в табл.2, сольем их и отметим время обесцвечивания растворов. Запишем в таблицу данные опыта. Относительную скорость реакции определим как 1/τ и результаты внесем в табл. 2.
Расчеты и анализ результатов опыта 1. Запишем правило Вант-Гоффа. ________________________________ Рассчитаем температурный коэффициент в интервалах: 30 – 40 °С ( ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. Построим график зависимости скорости реакции от температуры, отложив по оси абсцисс температуру, по оси ординат – относительную скорость.
Рисунок 2. ___________________________________________________ __________________________________________________________________
Какой вид имеет полученная зависимость?________________________ 3. Объясните, почему при увеличении температуры увеличивается скорость исследуемой реакции. Как это связано с изменением числа активных частиц ?___________________________________________________________ ____________________________________________________________________________________________________________________________________Запишите уравнение Аррениуса_______________________________________ __________________________________________________________________ 2.3. Вывод (о влиянии температуры на скорость реакции).____________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Поиск по сайту: |

 .
.
 .
.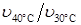 ),
),  (
(  ),
),  (
(  ), вычислим его среднее значение (γср). Выполняется ли для исследуемой реакции правило Вант‑Гоффа? От каких факторов зависит численное значение γ ?
), вычислим его среднее значение (γср). Выполняется ли для исследуемой реакции правило Вант‑Гоффа? От каких факторов зависит численное значение γ ?