 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Понятие о водородном показателе (рh)
Теория электролитической диссоциации ( Теория С. Аррениуса)
Эта теория подходит для разбавленных водных растворов электролитов. Электролитами называют вещества, водные роастворы которых или расплавы проводят электрический ток. ( электрический ток – направленное движение заряженных частиц. Молекулы всех веществ электронейтральны. Откуда берутся заряженные частицы?) Основные положения теории - в растворе или расплаве электролиты распадаются на ионы - ионы могут быть простыми ( K+ Ca@+ S2- Cl-) и сложными (SO42- NH4+ PO43-) - положительно заряженные ионыт называются катионы, т.к. притягиваются к отрицательно заряженному катоду. Отрицательно заряженные ионы называются анионы, т.к. притягиваются к положительно заряженному аноду - все ионы в растворе гидратировани, т.е покрыты слоем молекул растворителя.
В растворе электролиты диссоциируют(распадаются) по-разному. Характеризует процесс диссоциации степень диссоциации, которая показывает какая чапсть молекул электролита распалась на ионы: Степень диссоциации= число молекул, распавшихса на ионы Общее число молекул
Если электролит распадается полностью, то значение в числителе и знаменателе одинаковые и значение степени диссоциации равно 1 Чем сильнее электролит, тем ближе к 1 значение степени диссоциации. Если электролит диссоциирует слабо, число молекул, распавшихся на ионы , очень маленькое, то и значение степени диссоциации будет очень маленьким. К сильным электролитам относят электролиты со степенью диссоциации от 1 до 0,3, к средним электролитам – от 0,3 до 0,02, со степенью диссоциации менее 0,02 электролит считается слабым. Степень диссоциации зависит от: - концентрации электролита. Чем выше концентрация, тем меньше диссоциация - темперактуры раствора.Чем выше температура, тем больше диссоциация ( например, горячий маринад кислее, чем холодный, т.к. кислота диссоциирует рпри нагревании сильнее выделяется больше катионов водорода, которые отвечают за кислый вкус)
Сильные электролиты Кислоты: HCl HBr HI HClO4 HMnO4 H2SO4 HNO3 Основания: гидроксиды, образованные s-элементами 1 и s-элементами 11 группы,начиная с Ca NaOH KOH Ca(OH)2 Sr(OH)2 Ba(OH)2 Соли – практически все.
Кислоты, в зависимости от силы, диссоциируют по-разному. Сильные кислоты диссоциируют сразу и необратимо:
Слабые электролиты диссоциируют ступенчато и обратимо CH3COOH = CH3COO- + H+
H2CO3 = H+ + HCO3- HCO3- = H+ + CO32- Диссоциацию слабых кмслот , как обратимый процесс, характеризует константа диссоциации
К дис. CH3COOH = (CH3COO-)*(H+) (CH3COOH)
Для угольной кислоты, как двухосновной кислоты, будед характерно наличие
Кдис 1 ст Н2СО3 =(НСО3-)*(Н+) ( Н2СО3)
Кдис.2ст Н2СО3 = (СО32-)*(Н+) (НСО3-) Константа диссоциации, как любая константа обратимого процесса, - величина постоянная для каждого электролита ( зависит от природы вещества) и зависит от температуры раствора. Чем меньше константа диссоциации, тем слабее электролит. (К дис. – величина постоянная и ее можно найти в справочной таблице)
Основания –это электролиты, которые диссоциируют с образованием катиона металла и гидроксид-аниона. Сильные основания диссоциируют сразу и необратимо:
Слабые электролиты диссоциируют ступенчато и обратимо
Соли – сильные элпектролиты, поэтому в растворе сразу и полностью распадаются на катионы металла и анионы кислотного остатка.
Кислые соли диссоциируют сначала на катион металла и анион кислотного остатка
А затем кислотный остаток диссоцирует как кислота
Понятие о водородном показателе (рh) В качестве настворителя используют чаще всего воду. Вода относится хоть и к слабым, но электролитам и в растворе диссоциирует Н2О = Н+ +ОН- Как любой обратимый процесс,характеризуется своей константой диссоциации
Кдис. =(Н+)*(ОН-) (Н2О) Экспериментально доказано, что из 10000000 молекул только одна распадается на ионы.Поэтому концентрацию воды принимают за величину постоянную и получают следующее выражение
Кдис * ( Н2О) = Кw=(Н+)*(ОН-) =const=10-14 ( эта величина называется ионное произведение воды) Т.к. эта величина постоянная, то используется для расчета концентрации ионов Н+ или ОН- Например, (ОН-) =10-3 определить ( Н+) = ? ( Н+ ) = Кw = 10-14 =10-11 (OH-) 10-3
- (OH-) = 10-1 (H+) = 10-13 ph =13 - (OH-) = 10-5 ( H+) = 10-9 ph = 9 - ( OH-) = 10-7 ( H+) = 10-7 ph = 7 - (OH-) =10-10 ( H+) = 10-4 ph = 4 - (OH-) = 10-14 ( H+) =100=1 ph =1 Все последующие расчеты сделаны аналогично первому. Пользоваться дробными обозначениями концентраций неудобно, поэтому вводят понятие водородный показатель ( его значения приведены в крайнем правом столбце)
Ph = - lg ( H+) ( H+)= 10-6 ph=6, (H+) = 10-11 ph=11
Поиск по сайту: |

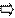 HCl H+ +Cl-
HCl H+ +Cl- КОН К+ + ОН-
КОН К+ + ОН-
 Mg(OH)2 MgOH+ + OH-
Mg(OH)2 MgOH+ + OH-
 MgOH+ Mg2+ + OH-
MgOH+ Mg2+ + OH-
 Na3PO4 3Na+ + PO43-
Na3PO4 3Na+ + PO43- NaHCO3 Na+ + HCO3-
NaHCO3 Na+ + HCO3-